
刘 吉,陆 强,蒋晓燕,胡 斌,董长青,杨勇平
(华北电力大学 生物质发电成套设备国家工程实验室,北京 102206)
摘 要:为了解碱金属离子对煤热利用过程中NOx污染物形成的影响,针对煤中含氮模型化合物吡咯,在吡咯常规非催化热解机理的研究基础上,采用密度泛函理论B3LYP/6-31+G(d,p)方法,研究了碱金属离子(Na+,K+)对吡咯催化热解反应机理和路径的影响。结果表明,碱金属离子能显著促进吡咯热解生成HCN路径中的内部氢转移反应、协同开环反应和协同裂解反应的发生,但对分子异构化反应的影响较小。Na+和K+ 均能降低吡咯热解生成HCN决速步的活化能,从而可促进HCN的形成,且两种碱金属离子的催化作用能力为Na+>K+。
关键词:吡咯;热解机理;密度泛函理论;碱金属离子;HCN
中图分类号:TQ530
文献标志码:A
文章编号:0253-9993(2018)09-2633-06

移动阅读
刘吉,陆强,蒋晓燕,等.碱金属离子对吡咯热解生成NOx前驱物HCN机理的影响[J].煤炭学报,2018,43(9):2633-2638.doi:10.13225/j.cnki.jccs.2017.1838
LIU Ji,LU Qiang,JIANG Xiaoyan,et al.Effect of alkali metal ions on the formation mechanism of HCN as NOx precursor during pyrrole pyrolysis[J].Journal of China Coal Society,2018,43(9):2633-2638.doi:10.13225/j.cnki.jccs.2017.1838
收稿日期:2017-12-27
修回日期:2018-04-11
责任编辑:许书阁
基金项目:国家重点基础研究发展计划(973)资助项目(2015CB251501);北京市科技新星资助项目(Z171100001117064);煤燃烧国家重点实验室开放基金资助项目(FSKLCCA1706)
作者简介:刘 吉(1986—),男,黑龙江五常人,博士研究生。E-mail:liujipower@126.com
通讯作者:陆 强(1982—),男,江苏江阴人,教授。Tel:010-61772030,E-mail:qianglu@mail.ustc.edu.cn
LIU Ji,LU Qiang,JIANG Xiaoyan,HU Bin,DONG Changqing,YANG Yongping
(National Engineering Laboratory for Biomass Power Generation Equipment,North China Electric Power University,Beijing 102206,China)
Abstract:Pyrrole is selected as the N-containing model compound for the investigation of the effect of alkali metal ions(Na+,K+) on NOx formation during coal thermal utilization process.Based on conventional non-catalytic mechanism studies,the density functional theory(DFT) method and B3LYP/6-31+G(d,p) basis set are adopted to elucidate the pyrolysis mechanism and pathways of pyrrole.The calculation results indicate that both Na+ and K+ show significant effects on the internal hydrogen transfer,ring-opening and concerted decomposition reactions,while rarely influence the internal hydrogen isomerization reaction.It is found that the alkali metal ions(Na+ and K+) can promote the formation of HCN from pyrrole through decreasing the activation energy of the rate-determining step.In addition,Na+ exhibits a better catalytic activity than K+.
Key words:pyrrole;pyrolysis mechanism;DFT;alkali metal ions;HCN
煤炭的使用是大气污染物NOx的主要来源之一[1]。煤中氮元素的主要存在形式为吡咯、吡啶和季氮[2-4],其中以吡咯形式存在的氮比重最高(50%~80%)[5]。吡咯在高温条件下热解先生成HCN,进而形成NOx[6-8],因此了解吡咯热解生成HCN的机理,对于深入研究燃煤过程中NOx的形成及其控制机制至关重要。
前人对煤的主要含氮模型化合物吡咯热解生成NOx前驱体的机理已有研究[9-12]。早期MACKIE等[9]通过实验指出,煤中氮的模型化合物吡咯热解时,其主要产物为丙炔、丙炔的同分异构体和HCN。MUHAMAD等[10]根据MACKIE等[9]的实验结果,应用密度泛函理论研究了吡咯热解生成HCN的路径机理,提出了内部氢转移诱发吡咯开环,后经异构化反应,最终协同裂解生成HCN的机理。ZHAI等[11]与 BACSKAY等[12]也进行了吡咯热解机理的研究,认为吡咯热解以内部氢转移为触发步的机理,其决速步能垒低,发生的可能性大,这一结论与MUHAMAD等[10]的研究成果相吻合。另外ELLIS等[13]和LINAK等[14]认为煤中所含灰分对煤的热化学反应有着重要影响,尤其灰分中的碱金属,对于煤中有机结构的热解/燃烧有显著催化作用[15]。然而前人的研究并未涉及金属离子对模型化合物吡咯热解机理的影响。考虑到煤灰分中含有的碱金属主要以Na+和K+形式存在[16-18](多与Cl-和有机分子结构上的羧基官能团结合[19]),因此本研究基于前人提出的吡咯热解生成HCN路径[10],通过密度泛函理论计算,重点探究碱金属离子(Na+,K+)对吡咯热解反应的影响机理。
煤中N主要以吡咯形式存在,吡咯为五元环含N有机物,其分子式为C4H4NH。经优化后的吡咯的空间结构如图1所示,其主要键长、键角等关键参数均已标出。主要原子按顺时针标记为C1,C2,C3,C4和N5,以便后续讨论。
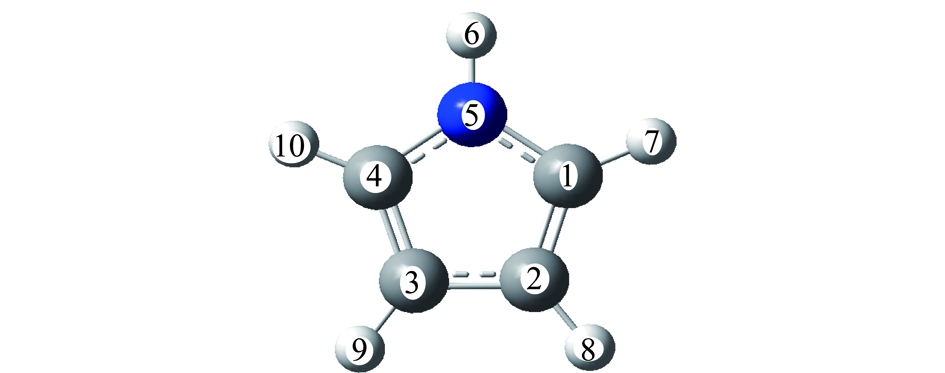
图1 模型化合物吡咯的结构
Fig.1 Molecular structure of pyrrole
本研究采用量子化学软件Gaussian 09程序[20]完成。基于密度泛函理论(DFT)中的B3LYP方法[21]和6-31+G(d,p)基组[22],对热解过程中的反应物、中间体、过渡态、产物进行几何结构的完全优化,再经过同一理论水平的频率计算获得298.15 K下的标准热力学参数;B3LYP/6-31+G(d,p)适合于大部分有机模型化合物的计算,且GLUKHOVTSEV等[23]通过不同机组的计算结果与实验结果对比,验证B3LYP/6-31+G(d,p)方法对金属离子与有机物体系优化和计算均具有很强的可靠性,因此该方法适合本研究的碱金属离子(Na+,K+)影响有机物热解机理[24]的研究。在频率计算过程中,确保反应物、中间体以及产物没有虚频,确认过渡态有惟一虚频,并用内禀反应坐标(IRC)计算来验证过渡态连接正确的反应物和产物;在构建反应路径图时,所有的能量均采用焓值计算反应活化能,气相的标准状态是298.15 K和101.325 kPa[25]。
MUHAMAD等[10]在先期的研究中已经深入研究并揭示了吡咯的常规热解机理,本研究首先采用B31YP/6-31+G(d,p)机组重新计算吡咯热解生成HCN的反应活化能和过渡态,作为后续催化热解反应机理的对比,结果如图2所示。吡咯首先内部氢转移诱发吡咯开环,经异构化反应,最终通过协同裂解反应生成HCN。具体反应过程如下:吡咯C2上的H原子,通过过渡态a-1t发生内部H转移反应转移到C3上,生成中间体a-1m,该步反应活化能为344.16 kJ/mol。随后,中间产物a-1m经开环反应,通过过渡态a-2t,吡咯上的N-C1键断裂生成中间体a-2m,该步反应活化能为338.72 kJ/mol。中间体a-2m通过过渡态a-3t发生异构化反应生成中间体a-3m,该过程活化能为316.55 kJ/mol。后经过渡态a-4t发生C3-C4键的协同裂解反应生成产物HCN与a-4m,其活化能为340.89 kJ/mol。需要说明的是,图2中的各过渡态活化能普遍高于MUHAMAD等[10]的研究结果,这是由于所采用的计算方法不同导致的。MUHAMAD等采用的计算方法为从头算的MP2,是通过计算每个电子的波函数最终求解薛定谔方程;虽计算精度较高,但无法处理电子之间的相互作用,也不适合计算弱键作用问题[26]。而密度泛函理论的B3LYP方法,是将电子的运动简化为电子密度的函数,从而代替波函数的变量求解薛定谔方程,可处理电子之间的相互作用和弱键作用问题[27]。这两种方法的不同计算逻辑也是导致计算结果差异的重要原因。由于本研究的主要内容,碱金属离子对吡咯热解的影响存在电子相互影响和弱键作用,因此密度泛函理论的B3LYP计算方法比MUHAMAD等采用的MP2方法更适合。SHISHKIN等[28]对上述两种方法进行了对比研究,认为B3LYP为混合杂化方程即使与MP2搭载相同机组时计算结果也有差异,而且两种方法计算活化能的高低与所计算的反应物类型密切相关,其中针对N原子参与的多种类型反应,B3LYP计算的频率和震动等均高于MP2法的结果,这也与Del BENE等[29]研究结果一致。因此本研究中计算的各过渡态活化能普遍高于MUHAMAD等[10]的计算结果。

图2 吡咯热解形成HCN的机理(单位:kJ/mol)
Fig.2 HCN formation mechanism from pyrolysis of pyrrole(Unit:kJ/mol)
为探究碱金属离子Na+对吡咯热解生成HCN过程的影响机制,分别从吡咯热解反应路径中的内部氢转移,协同开环,分子异构化和协同裂解4种反应,考察了Na+对各反应过渡态和中间体活化能的影响。
如图3所示,有碱金属Na+参与的吡咯热解生成HCN反应,首先吡咯C2位H原子通过内部转移到吡咯C3上,生成中间体a-n-1m,该步过渡态为a-n-1t,反应活化能为242.75 kJ/mol,比图2中无Na+参与反应的过渡态a-1t活化能低了101.41 kJ/mol,可知Na+的存在有效降低了吡咯环上内部H质子转移的活化能。后经中间体a-n-1m经开环反应,通过过渡态a-n-2t使N-C1键断裂,生成中间体a-n-2m,该步在反应的活化为272.42 kJ/mol,较图2中无Na+参与反应时的过渡态a-2t活化能降低了66.3 kJ/mol,因此Na+的存在降低了中间体a-n-1m开环反应的活化能。随后,中间体a-n-2m经过渡态a-n-3t发生异构化反应,该反应的活化能为313.14 kJ/mol,较图2中无碱金属离子影响的过渡态a-3t,其活化能低了3.41 kJ/mol,说明Na+的存在对中间体a-n-2m的异构化反应影响较小。最后,中间体a-n-3m通过过渡态a-n-4t发生C3-C4键断裂的协同裂解反应,生成产物a-n-4m和HCN,其反应活化能为318.13 kJ/mol,是此路径的决速步,该反应比无碱金属Na+影响的过渡态a-4t,其活化能低了22.76 kJ/mol,由此可知Na+的存在降低了a-n-3m中间体发生协同裂解反应的活化能,综上所述碱金属Na+整体上降低了NOx污染物前驱体生成的活化能,促进了HCN的形成。

图3 Na+对吡咯热解生成HCN的影响(单位:kJ/mol)
Fig.3 Effects of Na+ on pyrolysis of pyrrole to form HCN(Unit:kJ/mol)
同样地,分别从吡咯热解反应路径中的内部氢转移,协同开环,分子异构化和协同裂解4种反应,考察了K+对各反应过渡态和中间体的影响。
如图4所示,吡咯在K+的作用下,经过渡态a-k-1t发生内部H转移反应,生成中间体a-k-1m,其反应活化能为264.93 kJ/mol,这比图2中吡咯单独热解时过渡态a-1t的反应活化能低了79.23 kJ/mol。再经开环反应,中间体a-k-1m通过过渡态a-k-2t生成中间体a-k-2m,该步活化能为280.61 kJ/mol,较图2中吡咯单独热解反应过渡态a-2t的活化能降低了58.11 kJ/mol。随后,中间体a-k-2m经过渡态a-k-3t发生异构化反应生成中间体a-k-3m,该反应的活化能为324.59 kJ/mol,较图2中无K+影响的过渡态a-3t其活化能高了8.04 kJ/mol,说明K+的存在对中间体a-k-2m的异构化影响较小,这与Na+对该步反应的影响类似。最后,中间体a-k-3m通过过渡态a-k-4t发生协同裂解反应,生成产物a-n-4m和HCN,该步反应的活化能是322.44 kJ/mol,为此路径的决速步,比图2中无K+影响的过渡态a-4t活化能低18.45 kJ/mol。因此碱金属离子K+整体上降低了吡咯热解生成HCN的活化能。

图4 K+对吡咯热解形成NOx前驱体HCN的影响(单位:kJ/mol)
Fig.4 Effects of K+ on pyrolysis of pyrrole to form HCN(Unit:kJ/mol)
基于本研究与前人的研究结果,进一步对Na+与K+ 的催化作用机理进行分析,以深入了解其对于吡咯热解过程的影响机制。
如图5所示,Na+和K+对吡咯热解生成HCN路径影响的对比,吡咯N对位C2位上的H原子通过内部氢转移的方式,经过渡态a-1t生成中间体a-1m,碱金属离子Na+和K+显著降低了该步反应的活化能,且Na+的作用效果强于K+。对比不同情况下的该步反应过渡态a-1t,有 Na+存在比有K+存在情况下的活化能低22.18 kJ/mol。根据已有理论研究,该步反应活化能的降低是由于碱金属离子与吡咯环形成了π键[30],其作用强度数倍于氢键和范德华力[31],π键的形成改变了吡咯环原有的电子云密度分布,降低了其内部氢转移反应的能垒[32]并诱发了吡咯开环。在后续反应中,中间体a-1m经协同开环反应过渡态a-2t,生成中间体a-2m,可知Na+和K+显著降低了该步反应的活化能。特别的,在Na+作用情况下的过渡态a-2t活化能比K+作用时低8.19 kJ/mol,这说明Na+和K+均有促进中间体a-1m协同开环的作用,且Na+在反应中的作用强于K+。其机理在于K的金属性强于Na,Na的离子半径较小,因此Na+的极化性和静电力强于K+[33],从而导致了Na+对吡咯热解反应作用强于K+的结果。随后,中间体a-2m经过渡态a-3t发生分子异构化反应,有K+存在比无K+影响时的过渡态a-3t的活化能高8.04 kJ/mol,有Na+存在下比无Na+存在时的过渡态a-3t的活化能低3.41 kJ/mol,与前述两步中的内部氢转移反应和协同开环反应相比,可知碱金属离子(Na+,K+)对中间体a-2m的异构化反应影响有限。这是由于该过程未发生旧化学键断裂或新化学键形成的反应,如图5所示异构化过程仅发生了H质子所在二面角变化的反应,因此碱金属离子无法对该反应造成较大影响。最后,中间体a-3m通过过渡态a-4t发生协同裂解反应,生成产物a-4m和HCN,在Na+作用下的过渡态a-4t活化能比K+作用时低4.31 kJ/mol,由此可知Na+和K+的存在降低了中间体a-3m发生协同裂解反应的活化能,且Na+促进a-3m协同裂解作用好于K+。另外,有研究认为碱金属离子易与有机物分子的端部原子发生作用[34],且多价态原子更易与金属离子发生相互作用[35],这印证了文中的计算结果,即碱金属离子与过渡态a-4t中N原子发生作用,并降低了其上H原子断键能垒,促进了协同断裂反应的发生。综上所述碱金属离子(Na+,K+)的存在,整体上降低了HCN原有生成路径的活化能,促进了HCN的形成,且Na+的作用效果强于K+。

图5 碱金属离子Na+和K+对吡咯热解生成HCN路径的影响(单位:kJ/mol)
Fig.5 Different effects of alkali metal ions(Na+ and K+) on pyrolysis of pyrrole to form HCN(Unit:kJ/mol)
(1)碱金属离子(Na+,K+)能有效降低吡咯热解路径中的内部氢转移反应、协同开环反应和协同裂解反应的反应活化能;但对分子异构化反应的影响较小。
(2)Na+或K+能大幅降低吡咯热解生成HCN路径中决速步的活化能,促进NOx污染物前驱体HCN的形成。
(3)对两种碱金属离子促进吡咯热解生成HCN的反应机理的分析发现,Na+ 催化形成HCN的能力强于K+。
参考文献(References) :
[1] 杨冬,徐鸿,路春美,等.不同煤种在热解过程中氮的释放特性试验[J].煤炭学报,2007,32(1):77-80.
YANG Dong,XU Hong,LU Chunmei,et al.Experimental of the nitrogen releasing characteristics during pyrogenation of different coal[J].Journal of China Coal Society,2007,32(1):77-80.
[2] HASSAN F M,CHABOT V,LI J,et al.Pyrrolic-structure enriched nitrogen doped graphene for highly efficient next generation supercapacitors[J].Journal of Materials Chemistry A,2013,1(8):2904-2912.
[3] KELEMEN S R,GORBATY M L,KWIATEK P J.Quantification of nitrogen forms in argonne premium coals[J].Energy & Fuels,1994,8:896-906.
[4] WJTOWICZ M A,PELS J R,MOULIJN J A.The fate of nitrogen functionalities in coal during pyrolysis and combustion[J].Fuel,1995,74(4):507-516.
[5] KELEMEN S R,FREUND H,GORBATY M L,et al.Thermal chemistry of nitrogen in kerogen and low-rank coal[J].Energy & Fuels,1999,13(2):529-538.
[6] H M
M L
L INEN J P,AHO M J,TUMMAVUORI J L.Formation of nitrogen oxides from fuel-N through HCN and NH3:A model-compound study[J].Fuel,1994,73(12):1894-1898.
INEN J P,AHO M J,TUMMAVUORI J L.Formation of nitrogen oxides from fuel-N through HCN and NH3:A model-compound study[J].Fuel,1994,73(12):1894-1898.
[7] KIDENA K,HIROSE Y,AIBARA T,et al.Analysis of nitrogen-containing species during pyrolysis of coal at two different heating rates[J].Energy & Fuels,2000,14(1):184-189.
[8] 刘钦甫,徐占杰,崔晓南,等.不同煤化程度煤的热解及氮的释放行为[J].煤炭学报,2015,40(2):450-455.
LIU Qinfu,XU Zhanjie,CUI Xiaonan,et al.Release behavior of nitrogen in different rank coals during pyrolysis[J].Journal of China Coal Society,2015,40(2):450-455.
[9] MACKIE J C,COLKET M B,NELSON P F,et al.Shock tube pyrolysis of pyrrole and kinetic modeling[J].International Journal of Chemical Kinetics,1991,23(8):733-760.
[10] MARTOPRAWIRO M,BACSKAY G B,MACKIE J C.Ab initio qua-ntum chemical and kinetic modeling study of the pyrolysis kinetics of pyrrole[J].The Journal of Physical Chemistry A,1999,103(20):3923-3934.
[11] ZHAI L,ZHOU X,LIU R.A theoretical study of pyrolysis mechanisms of pyrrole[J].The Journal of Physical Chemistry A,1999,103(20):3917-3922.
[12] BACSKAY G B,MARTOPRAWIRO M,MACKIE J C.The thermal decomposition of pyrrole:An ab initio quantum chemical study of the potential energy surface associated with the hydrogen cyanide plus propyne channel[J].Chemical Physics Letters,1999,300(3):321-330.
[13] ELLIS N,MASNADI M S,ROBERTS D G,et al.Mineral matter interactions during co-pyrolysis of coal and biomass and their impact on intrinsic char co-gasification reactivity[J].Chemical Engineering Journal,2015,279:402-408.
[14] LINAK W P,YOO J I,WASSON S J,et al.Ultrafine ash aerosols from coal combustion:Characterization and health effects[J].Proceedings of the Combustion Institute,2007,31(2):1929-1937.
[15] WANG Y,WU H,S ROSSY Z,et al.Release and transformation of chlorine and potassium during pyrolysis of KCl doped biomass[J].Fuel,2017,197:422-432.
ROSSY Z,et al.Release and transformation of chlorine and potassium during pyrolysis of KCl doped biomass[J].Fuel,2017,197:422-432.
[16] DURIE R A.The science of Victorian brown coal:Structure,properties and consequences for utilization[M].Butterworth-Heinemann,2013;170-184.
[17] LI C Z,SATHE C,KERSHAW J R,et al.Fates and roles of alkali and alkaline earth metals during the pyrolysis of a Victorian brown coal[J].Fuel,2000,79(3-4):427-438.
[18] 魏砾宏,齐弟,李润东.碱金属对煤燃烧特性的影响及动力学分析[J].煤炭学报,2010,35(10):1706-1711.
WEI Shuohong,QI Di,LI Rundong.Effects of alkali metal on combustion of pulverized coal and kinetic analysis[J].Journal of China Coal Society,2010,35(10):1706-1711.
[19] QUYN D M,WU H,LI C Z.Volatilisation and catalytic effects of alkali and alkaline earth metallic species during the pyrolysis and gasification of Victorian brown coal.Part I.Volatilisation of Na and Cl from a set of NaCl-loaded samples[J].Fuel,2002,81(2):143-149.
[20] FRISCH M J,TRUCKS G W,SCHLEGEL H B,et al.Gaussian 09,revision D.01[M].Gaussian,Inc.,Wallingford CT,2009.
[21] BECKE A D.Becke’s three parameter hybrid method using the LYP correlation functional[J].The Journal of Chemical Physics,1993,98:5648-5652.
[22] MONTGOMERY J A,FRISCH M J,OCHTERSKI J W,et al.A complete basis set model chemistry.VI.Use of density functional geometries and frequencies[J].The Journal of Chemical Physics,1999,110(6):2822-2827.
[23] GLUKHOVTSEV M N,BACH R D,NAGEL C J.Performance of the B3LYP/ECP DFT calculations of iron-containing compounds[J].The Journal of Physical Chemistry A,1997,101(3):316-323.
[24] ZHANG Y,LIU C.A new horizon on effects of alkalis metal ions during biomass pyrolysis based on density function theory study[J].Journal of Analytical and Applied Pyrolysis,2014,110:297-304.
[25] LU Q,TIAN H,HU B,et al.Pyrolysis mechanism of holocellulose-based monosaccharides:The formation of hydroxyacetaldehyde[J].Journal of Analytical and Applied Pyrolysis,2016,120:15-26.
[26] CURTISS L A,RAGHAVACHARI K,POPLE J A.Gaussian-2 theory using reduced Mo/ller-Plesset orders[J].The Journal of Chemical Physics,1993,98(2):1293-1298.
[27] KACHUROVSKAYA N A,ZHIDOMIROV G M,HENSENEMIEL J M,et al.Cluster model DFT study of the intermediates of benzene to phenol oxidation by N2O on FeZSM-5 zeolites[J].Catalysis Letters,2003,86(1):25-31.
[28] SHISHKIN O V,GORB L,LUZANOV A V,et al.Structure and conformational flexibility of uracil:A comprehensive study of performance of the MP2,B3LYP and SCC-DFTB methods[J].Journal of Molecular Structure:Theochem,2003,625(1):295-303.
[29] DEL B J E,PERSON W B,SZCZEPANIAK K.Properties of hydrogen-bonded complexes obtained from the B3LYP functional with 6-31G(d,p) and 6-31+G(d,p) basis sets:Comparison with MP2/6-31+G(d,p) results and experimental data[J].The Journal of Physical Chemistry,1995,99(27):10705-10707.
[30] LHOT K P,SHINKAI S.Cation-π interactions in calix[n] arene and related systems[J].Journal of Physical Organic Chemistry,1997,10(5):273-285.
K P,SHINKAI S.Cation-π interactions in calix[n] arene and related systems[J].Journal of Physical Organic Chemistry,1997,10(5):273-285.
[31] KUMPF R A,DOUGHERTY D A.A mechanism for ion selectivity in potassium channels:Computational studies of cation-pi interactions[J].Science,1993,261:1708-1710.
[32] SOMERS K R F,KRYACHKO E S,CEULEMANS A.Theoretical study of alkali metal pyrrolides in comparison with n H- Pyrrole[J].The Journal of Physical Chemistry A,2003,107(28):5427-5438.
[33] MEYER E A,CASTELLANO R K,DIEDERICH F.Interactions with aromatic rings in chemical and biological recognition[J].Angewandte Chemie International Edition,2003,42(11):1210-1250.
[34] SIMOES J A M,BEAUCHAMP J L.Transition metal-hydrogen and metal-carbon bond strengths:The keys to catalysis[J].Chemical Reviews,1990,90(4):629-688.
[35] BENELLI C,GATTESCHI D.Magnetism of lanthanides in molecular materials with transition-metal ions and organic radicals[J].Chemical Reviews,2002,102(6):2369-2388.