为减少矿井瓦斯灾害的发生,在开采煤炭资源的同时需对瓦斯进行抽采,井下抽采得到的低浓度瓦斯中甲烷体积分数一般为5%~40%,利用难度较大,安全性差,尤其是对于一些偏远地区的煤矿,不具备管道输运的条件,存在直接排空的现象,在造成严重环境问题的同时,也存在大量的能源浪费[1-3]。在天然气化工领域,通过化学途径可将甲烷转化为烯烃、醇类等运输方便的高附加值化工原料[4-5],但以更具经济效益的煤矿瓦斯为原料通过催化转化实现其有效利用的相关研究较少。
以低浓度抽采瓦斯作为原料制取甲醇被认为是其理想的利用途径,主要是由于甲醇既保留了原料甲烷的主要化学能,也具有易于储运的特性。相比能耗高、工艺流程长的间接合成气法,甲烷直接部分氧化制甲醇具有工艺简单与能耗低等优点,受到国内外研究学者的广泛关注。如ZHANG Xin等以MoOx/La-Co-O为催化剂,在693 K,4.2 MPa的条件下可将甲烷部分氧化得到甲醇,但较高的反应温度很难避免甲醇的过度氧化[6];AHLQUIST等以铂配合物为催化剂、发烟硫酸为反应介质构建了甲烷液相催化氧化体系,虽可获得较高的甲烷转化率与甲醇回收率,但所需的强酸介质会对设备产生严重腐蚀,且从发烟硫酸中分离甲醇也比较困难[7];徐锋等利用低温等离子体活化甲烷,并与催化剂的定向转化相结合可实现瓦斯催化转化制甲醇,但所得氧化产物中甲醇选择性有待进一步提高[8]。因此,探寻可在温和条件下活化甲烷,且具有较高甲醇选择性的催化转化体系是实现低浓度瓦斯选择性合成甲醇的关键。
光催化技术利用光的能量代替传统热能可促使较难实现的高温反应在常温常压下进行[9],且温和的反应条件有利于得到较高的甲醇选择性[10]。杨娟等的研究结果表明利用光催化体系的光生空穴可实现常温常压下甲烷分子的有效活化[11-12],高效、稳定光催化剂的选取是低浓度瓦斯光催化转化的前提和关键,二氧化钛(TiO2)、氧化锌(ZnO)、硫化镉(CdS)、三氧化钨(WO3)等是光催化领域被深入研究的光催化材料。如XIE Jijia等以表面负载氧化铁的TiO2为光催化剂,在紫外光照射下可实现甲烷的催化氧化,甲醇选择性高达90%[13],但TiO2只能被占太阳光谱总能量3%的紫外光激发,无法利用约占太阳光能量42%的可见光部分;ZnO也可实现甲烷分子的光催化活化,但单一ZnO只能被紫外光激发,且其光催化活性较低,常需负载纳米金等贵金属以提高ZnO的光催化性能[14];CdS虽可吸收可见光,但单一CdS在可见光照射下易发生光腐蚀现象,且CdS的价带电势较高,产生的光空穴氧化能力不足以活化甲烷分子[15]。相对于TiO2,ZnO与CdS,WO3不仅具有良好的化学稳定性与抗光腐蚀性,且具有较小的禁带宽度(2.4~2.8 eV)和较深的价带电势,能有效吸收可见光并产生具有强氧化性的活性物种。此外,半导体光催化属于异相反应体系,其催化性能较大程度上受催化剂比表面积与孔结构特性的影响。同时,有研究表明光催化剂的有序孔道结构可加快光生电子在其表面的迁移速率,抑制光生电子与空穴的复合,进而提升光催化性能[16]。
为了有效利用太阳能驱动低浓度瓦斯的光催化转化,笔者选用具有可见光响应的深价带半导体WO3为光催化活性组分,以有序多孔二氧化硅KIT-6为模板剂制备介孔WO3,通过外加电子捕获剂H2O2构建低浓度瓦斯光催化转化体系,系统考察H2O2用量、瓦斯初始体积分数、可见光照射时间等对瓦斯转化率与甲醇选择性的影响,利用电子顺磁共振技术检测瓦斯转化过程中的活性自由基,揭示瓦斯可见光催化转化制甲醇的反应机制,为温和条件下低浓度瓦斯的转化利用提供借鉴。
1 实验部分
1.1 催化剂制备
将14.0 g磷钨酸溶于一定量的乙醇中,在剧烈搅拌下加入0.8 g KIT-6介孔分子筛模板剂,所得混合物在100 ℃下干燥5 h,随后置于管式炉中于350 ℃下煅烧4 h,进一步升温至550 ℃煅烧6 h,得到有序介孔WO3前驱体,将所得样品分散于10% HF溶液中,室温搅拌8 h以去除KIT-6模板剂,最后分别用水和乙醇洗涤并于室温下干燥,即制得具有有序介孔结构的WO3。
1.2 表征方法
采用德国Bruker D8 Advance型X-射线衍射仪分析样品的晶型结构,采用美国康塔仪器公司 Autosorb-IQ型气体吸附仪测定催化剂的低温氮气吸附-脱附等温线,以此分析样品的比表面积与孔结构,采用日立S4800冷场发射扫描电子显微镜与JEOL JEM-2100 型透射电子显微镜观测样品的微观形貌。
1.3 光催化实验
介孔WO3/H2O2催化低浓度瓦斯制甲醇的性能实验在体积为100 mL的自制光催化反应器中进行,以不同体积分数的甲烷、氮气混合气体模拟低浓度抽采瓦斯。实验装置如图1所示,实验过程中使用冷却水将反应温度控制在25±1 ℃,采用带有420 nm滤光片的300 W氙灯为可见光源,经由光功率计测得反应器上端光照强度为120 mW/cm2。首先将10 mg催化剂超声分散于18 mL去离子水中,密封反应器并由甲烷和氮气混合气体对反应器进行吹扫,在光照之前将2 mL一定物质的量浓度的H2O2溶液加入反应器中(反应釜中液体体积保持为20 mL)。光照后每隔一段时间使用气体阀门型微量进样器从反应器中取样,采用配备有火焰离子化检测器的气相色谱(岛津 GC-2014)对甲醇的生成及甲烷的转化进行检测。

图1 实验装置示意
Fig.1 Schematic diagram of the experimental setup
2 结果与讨论
2.1 催化剂表征
通过广角X-射线衍射(XRD)和小角X-射线衍射(SAXS)对介孔WO3和模板剂KIT-6的晶体结构进行表征。如图2(a)所示,在2θ=23.6°,33.6°,41.5°处的衍射峰可归属于单斜晶相WO3(JCPDS 46-1096)的(200),(220),(222)晶面衍射,从图2(a)还可看出实验制备的介孔WO3 XRD谱图的衍射峰与标准PDF卡片中峰的位置基本吻合,表明所制介孔WO3为纯的单斜晶相[17],使用Scherrer方程计算介孔WO3晶粒平均尺寸为24.4 nm。由图2(b)的小角XRD衍射图可看出模板剂KIT-6在2θ=0.5°~2.5°显示出明显的衍射峰,分别归属为具有介孔孔道结构氧化硅的(211),(220)和(321)晶面衍射[16,18],且介孔WO3图谱在2θ=0.98°附近也有一个明显的衍射峰,对应于KIT-6的(211)晶面衍射,表明采用1.1节的实验方法可使样品WO3成功地保留KIT-6模板剂的有序中孔结构。WO3的介孔结构一方面可以提高催化剂的比表面积,有利于增强低浓度瓦斯的表面吸附,同时,其介孔结构特性可显著提升光生电子-空穴的分离效率,改善WO3的可见光光催化氧化性能[16]。

图2 介孔WO3,KIT-6的XRD谱
Fig.2 XRD patterns of mesoporous WO3 and KIT-6
通过扫描电子显微镜(SEM)和透射电子显微(TEM)对样品的微观形貌进行观测,图3(a)是所制介孔WO3的SEM图片,从图中可看出WO3颗粒尺寸分布均匀,其晶粒尺寸约为26.3 nm,与基于XRD谱图及Scherrer方程的计算结果相近。从图3(b)的TEM图像可清楚地观察到所制WO3样品具有高度有序的多孔结构,进一步表明WO3较好地保留了模板剂KIT-6的介孔孔道结构[16]。
光催化氧化属于异相反应,其催化性能较大程度上取决于催化剂的比表面积与孔结构特性,图4为所制介孔WO3的N2吸附-脱附等温线和孔径分布图,WO3样品呈现出Ⅳ型等温吸附曲线,且在P/P0>0.5处出现H3型滞后环,表明该样品具有介孔结构特性。孔径主要分布在3~5 nm和10~16 nm,其中3~5 nm的孔尺寸与KIT-6模板剂的孔壁厚相近,这一范围的孔径是由于有序介孔WO3完全保留了KIT-6模板剂的孔结构;而10~16 nm范围内的孔主要是由于纳米级WO3颗粒之间相互堆积形成的空隙。

图3 有序介孔WO3的SEM和TEM照片
Fig.3 SEM and TEM images of ordered mesoporous WO3

图4 介孔WO3的N2吸附-脱附等温线及其孔径分布
Fig.4 N2 adsorption-desorption isotherms and the corresp-
onding pore size distribution curves for mesoporous WO3
样品的比表面积、孔径等相关信息见表1,未以KIT-6为模板剂所制WO3的比表面积和总孔体积为8.5 m2/g与0.04 cm3/g,而以介孔KIT-6二氧化硅为模板剂制备的有序介孔WO3,其比表面积和孔体积为78.6 m2/g与0.21 cm3/g,分别提高了824%和425%。高的比表面积与丰富的介孔结构可促使甲烷分子及H2O2与催化剂表面活性位的有效接触。
表1 不同样品的孔结构分布与比表面积
Table 1 Pore structure and specific surface area of different samples

催化剂BET比表面积/(m2·g-1)总孔体积/(cm3·g-1)BJH平均孔径/nmKIT-6679.01.196.80WO38.50.0426.00有序介孔WO378.60.213.93,12.41
2.2 光催化转化甲烷制甲醇性能研究
在整个反应体系中甲烷的转化率与目标产物甲醇的选择性是评价有序介孔WO3催化性能的主要指标,实验过程中甲烷的消耗以及产物的生成均利用气相色谱进行检测,甲烷转化率及甲醇的选择为
CH4的转化率=

CH3OH的选择性=

其中,P为反应器内的气体压力,Pa;V为反应釜内气体体积,m3;T为反应温度,K;R为气体常数,J/(mol·K);x(CH4)为反应器内CH4的体积分数,%;x(C2H6),x(CO2)分别为C2H6,CO2的体积分数,%;n(CH3OH)为产物中CH3OH的物质的量,mol。
介孔WO3+可见光![]() e-+h+
e-+h+
(1)
h++CH4![]() ·CH3+H+
·CH3+H+
(2)
H2O2+e-![]() ·OH+OH-
·OH+OH-
(3)
·CH3+·OH![]() CH3OH
CH3OH
(4)
·CH3+·CH3![]() C2H6
C2H6
(5)
CH3OH 或 C2H6+·OH![]() CO2+H2O
CO2+H2O
(6)
在光催化氧化甲烷制甲醇的反应过程中,H2O2首先作为电子捕获剂,可显著抑制光生电子与空穴的复合[19-20],有利于光空穴的生成与甲烷分子的活化,如反应式(1),(2)所示;同时,H2O2得到WO3的导带电子生成羟基自由基(·OH)[19-20],并与甲烷活化产生的甲基自由基相结合(·CH3),得到产物甲醇,即H2O2同时起到氧化剂的作用,如反应式(3),(4)所示。在构建的WO3/H2O2可见光催化体系中,除了可生成产物甲醇外,两个·CH3也可能经由偶联反应得到乙烷(C2H6),同时还可能发生甲醇或乙烷的深度氧化过程,即被过量的·OH氧化最终转化为CO2与H2O。

图5 不同可见光催化体系中甲烷转化率、甲醇选择性
与甲醇生成量
Fig.5 Methane conversion,methanol selectivity and production quantity of different visible-light catalytic systems
为了确定可见光、介孔WO3、H2O2对甲烷光催化转化的影响,采用1.3节的实验方法,以CH4体积分数为20%的模拟瓦斯气体为研究对象,分别开展了以下实验研究:仅在可见光照射下(波长≥420 nm),甲烷的转化率几乎为0;根据王心晨等[21]的报道,可见光照射H2O2可使其发生少量分解产生羟基自由基,·OH能将甲烷氧化成甲醇和乙烷,但经120 min可见光照射后甲烷的转化率仅为2.8%,甲醇选择性仅为29.5%,如图5(a)所示;单一WO3光催化体系产生的光空穴虽可实现甲烷的活化与转化,但由于单一WO3光生电子与空穴的分离效率较低,反应体系中用于活化或转化甲烷的活性物种浓度较低,使得甲烷的转化率仅为3.0%,甲醇选择性为42.1%。在介孔WO3与H2O2同时存在的可见光体系中(H2O2 13.5 mmol/L),当反应进行至120 min时,CH3OH的生成量达到峰值,其最大生成量为14.73 mmol/g,远高于单纯H2O2体系的甲醇生成量(0.59 mmol/g)及单一WO3体系产生的甲醇量(0.91 mmol/g),如图5(b)所示;此时,WO3/H2O2可见光体系中甲烷的转化率为24.9%,甲醇选择性为82.5%,表明介孔WO3与氧化剂H2O2在可见光转化甲烷制甲醇的过程中均起决定性作用。而且,WO3/H2O2光催化体系中甲烷转化率与甲醇选择性优于文献中报道的以负载钯酞菁铜[22]或负载NiO的CeZrOx为催化剂[23]的甲烷转化性能。
(1)H2O2物质的量浓度的影响:通过在反应体系中添加不同物质的量浓度的H2O2来研究羟基自由基对介孔WO3光催化性能的影响,结果如图6所示。对于甲烷初始体积分数为10%,20%与30%的模拟瓦斯,其H2O2的最佳物质的量浓度分别为6.8,13.5,13.5 mmol/L,但甲烷体积分数为30%的模拟瓦斯在H2O2物质的量浓度为20.3 mmol/L时具有与最佳H2O2相近的甲醇选择性。以甲烷体积分数为20%的模拟瓦斯为例,光照120 min后,在未加入H2O2的可见光体系中甲烷的转化率仅为3.0%,且有53.5%的甲烷直接转化成了CO2,甲醇的选择性只有42.1%;随着H2O2物质的量浓度的增加,甲醇的生成量急剧增加,当加入H2O2为13.5 mmol/L时,甲醇的生成量增加至14.73 mmol/g,其选择性高达82.5%,与此同时,甲烷的转化率也提高至24.9%;此后随着H2O2物质的量浓度的升高,甲烷的转化率逐渐增加,但产物中甲醇的选择性反而降低,C2H6和CO2的生成量有所增加,这说明过量的H2O2虽可有效捕获WO3的导电电子,为活化甲烷提供更多的光空穴,产生更高浓度的·CH3,但H2O2分解同时产生过量的·OH,导致产物甲醇的深度氧化,这一结果与之前的研究报道相一致[13,24],同时表明合适的H2O2对介孔WO3可见光体系甲烷转化率与甲醇选择性起重要作用。对于甲烷体积分数为10%和30%的模拟瓦斯,H2O2对甲醇生成也有类似的影响,其总的规律为随甲烷初始体积分数的增加,达到甲醇最佳选择性所需H2O2物质的量浓度逐渐增大。

图6 不同浓度H2O2对甲烷转化产物生成量与甲醇选择性的影响
Fig.6 Effect of different concentrations of H2O2 on product quantity of methane conversion and methanol seletivity
(2)甲烷初始体积分数的影响:介孔WO3在13.5 mmol/L的H2O2物质的量浓度条件下对不同甲烷初始体积分数的模拟瓦斯光催化转化效果如图7所示。图7(a)为甲烷转化率随反应时间的变化,对于甲烷初始体积分数为5%,10%,20%与30%的模拟瓦斯,采用WO3/H2O2可见光氧化体系均可实现甲烷的室温转化,但相同条件下随甲烷初始浓度的增加,其转化率逐渐降低。据文献报道,异相光催化反应常采用Langmuir-Hinshelwood动力学模型描述[25-26],通过分析不同初始体积分数甲烷的转化率,得出甲烷的光催化氧化为准一级反应,并遵循式(7)所示动力学方程:
![]()
(7)
其中,k′为拟一级反应速率常数,min-1;C/C0为归一化处理的未转化甲烷浓度。ln(C0/C)与反应时间t呈线性关系,如图7(b)所示,其直线斜率即为拟一级反应速率常数。当甲烷初始体积分数为5%,10%,20%与30%时,其表观速率常数k′分别为4.56×10-3,3.45×10-3,2.27×10-3和1.22×10-3 min-1(相关系数均大于0.996),表明构建的WO3/H2O2光催化体系更适合转化低浓度矿井瓦斯。

图7 模拟瓦斯光催化转化动力学数据
Fig.7 Kinetic data of photocatalytic conversion of simulated gas
(3)可见光照射强度的影响:光催化反应是以催化剂吸收的光能为驱动力,将光能转化为化学能的反应过程,图8给出了光照强度对5%模拟瓦斯转化率与甲醇选择性的影响结果。从图8可看出,甲烷转化率与可见光照射强度呈正相关,确定甲烷在WO3/H2O2体系中的转化为可见光驱动的反应过程;但对甲烷初始体积分数为5%的模拟瓦斯、H2O2物质的量浓度为13.5 mmol/L时,甲醇选择性反而随光照强度的增加略有降低,这表明甲烷转化率与甲醇选择性存在相互制约的关系,高的甲烷转化率与甲醇选择性不仅与光照强度有关,还受甲烷初始浓度、H2O2物质的量浓度、催化剂组成等条件的影响。

图8 可见光照射强度对5%模拟瓦斯转化率与甲醇
选择性的影响
Fig.8 Effect of visible-light irradiation intensity on CH4conversion (5% imitative gas) and CH3OH selectivity
(4)氧气含量的影响:井下瓦斯抽采过程中由于“漏气圈”的存在,不可避免地会漏入空气,使得低浓度瓦斯中含有一定量的氧气。为研究氧气体积分数对WO3/H2O2光催化甲烷转化率与甲醇产生量的影响,以不同氧气含量的模拟瓦斯为原料气进行了光催化转化实验,结果如图9所示。以甲烷初始体积分数为20%,氧气体积分数分别为0%,5%,10%,15%的模拟瓦斯为研究对象,光照120 min后,乙烷产生量随氧气体积分数的增加有所减少,二氧化碳产生量随氧气体积分数的增加略有增加,但氧气的存在对WO3/H2O2光催化体系甲烷转化率与甲醇生成量影响不大。

图9 氧气体积分数对20%模拟瓦斯光催化转化产物生成量
与甲烷转化率的影响
Fig.9 Effect of O2 volume fraction on product generation amount
and CH4 (20% imitative gas) photocatalytic conversion yield
除催化活性外,催化剂稳定性被认为是决定光催化技术实际应用的另一个重要因素。对所制介孔WO3进行6次循环实验,结果如图10所示,第1次循环后甲醇产量与选择性为14.73 mmol/g和82.5%,第6次循环实验后甲醇产率仍可达13.98 mmol/g,甲醇选择性为80.3%,6次循环实验后甲醇生成量与选择性几乎没有改变。同时,通过对新制催化剂与循环使用后WO3的晶体结构与微观形貌进行XRD和TEM表征,也未发现明显变化,表明有序介孔WO3具有优异的稳定性。

图10 光催化转化20%模拟瓦斯制甲醇的稳定性实验
Fig.10 Recycled test for photocatalytic conversion of 20% imitative gas to methanol
2.3 低浓度瓦斯制甲醇的光氧化机理

图11 H2O2对CP·电子自旋共振信号强度与甲烷转
化率的影响
Fig.11 Effect of H2O2 addition on electron spin resonance signal intensity of CP· and methane conversion rate
有文献报道[13,26],光生空穴(h+)是深价带半导体催化剂活化甲烷等分子C—H的主要活性物种,为了研究WO3/H2O2可见光体系光空穴的生成与甲烷转化率间的关系,采用电子自旋共振(ESR)技术对光空穴进行检测。选用1-羟基-3-羧基-2,2,5,5-四甲基吡咯烷(CPH)作为光空穴的自旋标记物[27-28],如图11(a)所示,单一CPH没有ESR信号,CPH/WO3悬浮液在可见光照射下出现强度比1∶1∶1的三重峰,这一ESR型号应归属于光空穴氧化CPH生成的氮氧自由基CP·的特征谱图[28],添加H2O2至CPH/WO3悬浮液可使该三重峰的强度显著增加,表明H2O2经由捕获WO3导带的光电子能增强光生空穴与电子的分离,产生更高浓度的光空穴。更重要的是,以甲烷初始体积分数为20%的模拟瓦斯为例,随H2O2添加的变化,所构建的介孔WO3/H2O2光催化体系中氮氧自由基CP·的ESR信号强度与甲烷转化率呈现一致的变化趋势(图11(b)),进一步确定光空穴是活化甲烷的主要物种。
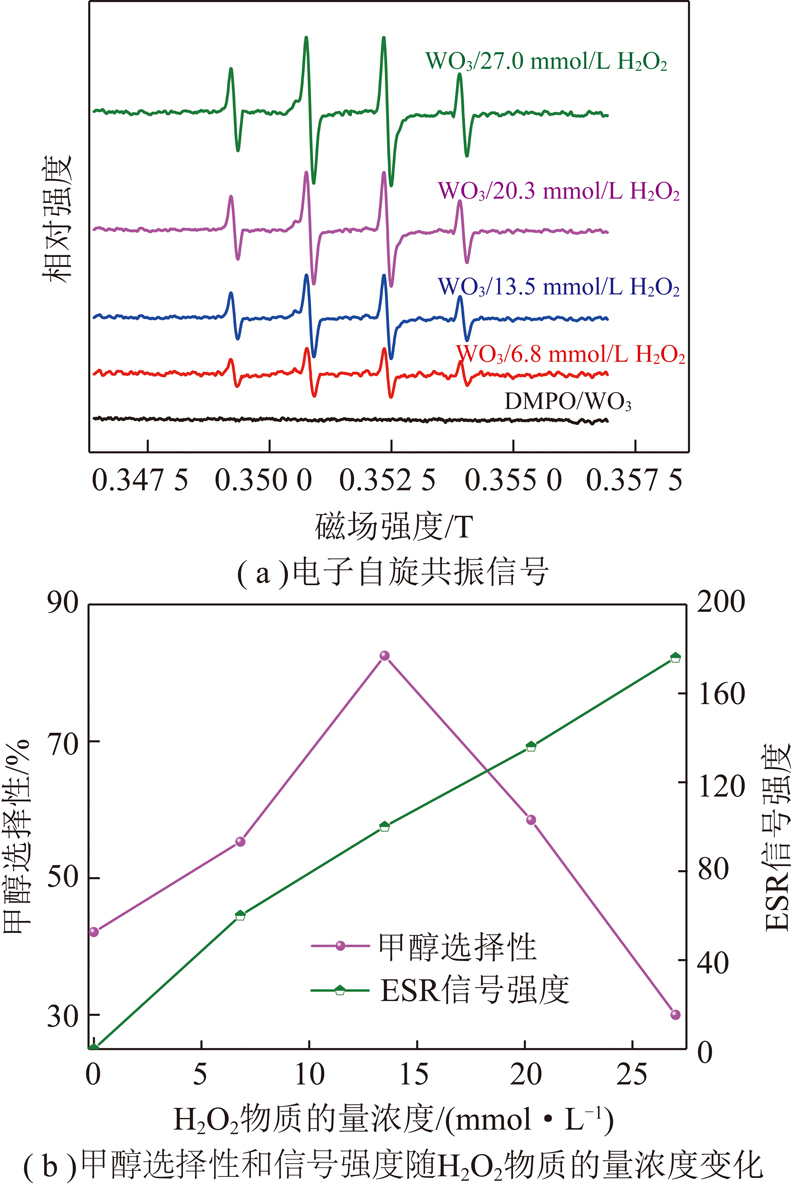
图12 H2O2对DMPO/·OH电子自旋共振信号强度与
甲醇选择性的影响
Fig.12 Effect of H2O2 addition on electron spin resonance signal intensity of DMPO/·OH and methanol selectivity
H2O2首先被WO3导带的光电子还原,发生分解反应生成·OH,继而与甲烷活化产生的·CH3结合,得到目标产物甲醇。选用二甲基吡啶氮氧化物(DMPO)作为·OH的自旋捕获剂[29],研究了·OH生成与甲醇选择性间的关系。从图12(a)可看出,单一WO3在可见光照射下不能产生·OH,添加H2O2至DMPO/WO3悬浮体系能产生明显的ESR信号,该强度比为1∶2∶2∶1的四重峰属于DMPO/·OH加合物的特征谱图[29],而且该ESR信号强度与H2O2物质的量浓度呈正相关,表明体系中·OH生成量随H2O2物质的量浓度的增加而增加。但通过与甲烷初始体积分数为20%的模拟瓦斯转化体系中甲醇选择性结果进行对比(图12(b)),得出在H2O2物质的量浓度不高于13.5 mmol/L时,体系中·OH生成量与甲醇选择性随H2O2物质的量浓度的变化趋势相一致,进一步增大H2O2添加量,虽可提高·OH生成量,但甲醇选择性反而降低,这表明过量的·OH可能导致甲醇发生过度氧化。
基于以上实验结果,得出如图13所示的光催化转化甲烷制甲醇的反应机理:介孔WO3吸收可见光被激发产生光生空穴(h+)和光生电子(e-)(式(1)),甲烷分子经由h+抽氢反应生成甲基自由基(式(2)),H2O2得到WO3导带的光电子被还原分解为·OH(式(3)),并进一步与甲基自由基·CH3结合,生成产物甲醇(式(4))。

图13 WO3/H2O2体系光生电荷转移与甲醇生成机理示意
Fig.13 Schematic diagram of photogenerated charge transfer in WO3/H2O2 system and methanol formation
3 结 论
(1)介孔WO3/H2O2可见光催化体系可用于常温常压下转化低浓度瓦斯制甲醇,对于甲烷初始体积分数为20%的瓦斯,在物质的量浓度为13.5 mmol/L H2O2的协同作用下,可见光照射120 min得到的甲醇生成量为14.73 mmol/g,选择性达到82.5%。
(2)甲烷初始体积分数、可见光照强度、H2O2物质的量浓度等条件均会影响瓦斯转化效果,不同甲烷体积分数模拟瓦斯有不同的最佳H2O2用量,甲烷转化率与甲醇选择性随H2O2物质的量浓度的增加而增加,但H2O2用量超过最佳时,进一步增加H2O2,甲烷转化率仍逐渐升高,但过量的·OH导致甲醇过度氧化,使其选择性降低。
(3)介孔WO3吸收可见光产生的光空穴是活化甲烷分子的主要物种,甲烷分子经由h+抽氢反应生成·CH3,H2O2作为电子捕获剂可增强光空穴的生成,提升甲烷转化率;H2O2被还原分解产生的·OH与·CH3反应,得到产物甲醇,即·OH是甲醇生成的主要氧化物种,但体系中·OH对甲烷转化率与甲醇选择性影响的内在机理尚需进一步研究。
[1] 杨雄,张传钊,孟宇,等.煤矿乏风瓦斯富集中试试验研究[J].煤炭学报,2014,39(3):486-491.
YANG Xiong,ZHANG Chuanzhao,MENG Yu,et,al.Pilot-scale study of ventilation air methane enrichment[J].Journal of China Coal Society,2014,39(3):486-491.
[2] 宋正昶,林柏泉,周世宁.低浓度瓦斯在泡沫陶瓷内过焓燃烧的实验研究[J].煤炭学报,2011,36(4):628-632.
SONG Zhengchang,LIN Baiquan,ZHOU Shining.Experimental study on the excess-enthalpy combustion of low concentration methane in ceramic foams[J].Journal of China Coal Society,2011,36(4):628-632.
[3] 申宝宏,刘见中,雷毅.我国煤矿区煤层气开发利用技术现状及展望[J].煤炭科学技术,2015,43(2):1-4.
SHEN Baohong,LIU Jianzhong,LEI Yi.Present status and prospects of coalbed methane development and utilization technology of coal mine area in China[J].Coal Science and Technology,2015,43(2):1-4.
[4] HAN B Z,YANG Y,XU Y Y,et al.A review of the direct oxidation of methane to methanol[J].Chinese Journal of Catalysis,2016,37(8):1206-1215.
[5] ZAKARIA Z,KAMARUDIN S.Direct conversion technologies of methane to methanol:An overview[J].Renewable and Sustainable Energy Reviews,2016,65:250-261.
[6] ZHANG X,HE D H,ZHANG Q J,et al.Comparative studies on direct conversion of methane to methanol/formaldehyde over La-Co-O and ZrO2 supported molybdenum oxide catalysts[J].Topics in Catalysis,2005,32(3-4):215-223.
[7] AHLQUIST M,NIELSEN R J,PERIANA R A,et al.Product protection,the key to developing high performance methane selective oxidation catalysts[J].Journal of the American Chemical Society,2009,131(47):17110-17115.
[8] 徐锋,李凡,朱丽华,等.Cu-Zn-Al 基催化剂制备及催化等离子体转化甲烷制甲醇[J].高校化学工程学报,2018,32(4):869-876.
XU Feng,LI Fan,ZHU Lihua,et al.Preparation of Cu-Zn-Al-based catalysts and their application in methane conversion to methanol by plasma[J].Journal of Chemical Engineering of Chinese Universities,2018,32(4):869-876.
[9] LI L,FAN S Z,MU X Y,et al.Photoinduced conversion of methane into benzene over GaN nanowires[J].Journal of the American Chemical Society,2014,136(22):7793-7796.
[10] 汪家喜,魏晓骏,沈佳宇,等.光催化选择性合成有机物[J].化学进展,2014,26(9):1460-1470.
WANG Jiaxi,WEI Xiaojun,SHEN Jiayu,et al.Photocatalytic selective transformation of organics[J].Progress in Chemistry,2014,26(9):1460-1470.
[11] 杨娟,郝静怡,魏建平,等.吸附型复合催化剂光催化消除煤矿瓦斯的机理[J].煤炭学报,2018,43(8):2250-2255.
YANG Juan,HAO Jingyi,WEI Jianping,et al.Mechanism on photocatalytic elimination of coal-mine gas over adsorption-type composite catalysts[J].Journal of China Coal Society,2018,43(8):2250-2255.
[12] WEI J P,YANG J,WEN Z H,et al.Efficient photocatalytic oxidation of methane over b-Ga2O3/activated carbon composites[J].RSC Advances,2017,7(60):37508-37521.
[13] XIE J J,JIN R X,LI A,et al.Highly selective oxidation of methane to methanol at ambient conditions by titanium dioxide-supported iron species[J].Nature Catalysis,2018,1(11):889-896.
[14] MENG L S,CHEN Z Y,MA Z Y,et al.Gold plasmon-induced photocatalytic dehydrogenative coupling of methane to ethane on polar oxide surfaces[J].Energy & Environmental Science,2018,11(2):294-298.
[15] GAO P,LIU J C,SUN D D,et al.Graphene oxide-CdS composite with high photocatalytic degradation and disinfection activities under visible light irradiation[J].Journal of Hazardous Materials,2013,250:412-420.
[16] WANG L C,WANG Y,CHENG Y,et al.Hydrogen-treated mesoporous WO3 as a reduction agent of CO2 to fuels (CH4 and CH3OH) with enhanced photo-thermal catalytic performances[J].Journal of Materials Chemistry A,2016,4(14):5314-5322.
[17] HAMEED A,ISMAIL I M,ASLAM M,et al.Photocatalytic conversion of methane into methanol:Performance of silver impregnated WO3[J].Applied Catalysis A-General,2014,470:327-335.
[18] WANG Y L,CUI X B,YANG Q Y,et al.Preparation of Ag-loaded mesoporous WO3 and its enhanced NO2 sensing performance[J].Sensors and Actuators B-Chemical,2016,225:544-552.
[19] 马海艳,赵利霞,张辉,等.H2O2调控TiO2体系中活性氧物种的产生及其五氯酚的降解过程[J].中国科学:化学,2018,48(10):1280-1289.
MA Haiyan,ZHAO Lixia,ZHANG Hui,et al.H2O2 regulates the production of reactive oxygen species in TiO2 system and the degradation process of pentachlorophenol[J].Scientia Sinica Chimica,2018,48(10):1280-1289.
[20] ZHANG J,NOSAKA Y.Generation of OH radicals and oxidation mechanism in photocatalysis of WO3 and BiVO4 powders[J].Journal of Photochemistry and Photobiology A-Chemistry,2015,303:53-58.
[21] WANG B,ANPO M,LIN J,et al.Direct hydroxylation of benzene to phenol on h-BCN nanosheets in the presence of FeCl3 and H2O2 under visible light[J].Catalysis Today,2019,324:73-82.
[22] 朱丽华,徐锋,王珏,等.醋酸溶液中Pd-CuPc/Y催化甲烷选择氧化制甲醇[J].燃料化学学报,2013,41(8):985-990.
ZHU Li hua,XU Feng,WANG Jue,et al.Selective oxidation of methane to methanol in acetic acid solvent over Pd-CuPc/Y catalyst[J].Journal of Fuel Chemistry and Technology,2013,41(8):985-990.
[23] OKOLIE C,BELHSEINE Y F,LYU Y M,et al.Conversion of methane into methanol and ethanol over Nickel oxide on Ceria-Zirconia catalysts in a single reactor[J].Angewandte Chemie-International Edition,2017,56(44):13876-13881.
[24] MURCIA-LOPEZ S,VILLA K,ANDREU T,et al.Improved selectivity for partial oxidation of methane to methanol in the presence of nitrite ions and BiVO4 photocatalyst[J].Chemical Communications,2015,51(33):7249-7252.
[25] HOFFMANN M R,MARTIN S T,CHOI W,et al.Environmental applications of semiconductor photocatalysis[J].Chemical Reviews,1995,95(1):69-96.
[26] CHEN X X,LI Y P,PAN X Y,et al.Photocatalytic oxidation of methane over silver decorated zinc oxide nanocatalysts[J].Nature Communications,2016,7:12273.
[27] JIA H M,HE W W,WAMER W G,et al.Generation of reactive oxygen species,electrons/holes,and photocatalytic degradation of Rhodamine B by photoexcited CdS and Ag2S micro-nano structures[J].Journal of Physical Chemistry C,2014,118(37):21447-21456.
[28] HE W W,KIM H K,WAMER W G.et al.Photogenerated charge carriers and reactive oxygen species in ZnO/Au hybrid nanostructures with enhanced photocatalytic and antibacterial activity[J].Journal of the American Chemical Society,2014,136(2):750-757.
[29] 陈美娟,黄宇,李顺诚.盐辅助-超生喷雾热分解法合成中空Bi2WO6纳米微球去除NO的应用[J].催化学报,2017,38(2):348-356.
CHEN Meijuan,HUANG Yu,LI Shuncheng.Salt-assisted synthesis of hollow Bi2WO6 microspheres with superior photocatalytic activity for NO removal[J].Chinese Journal of Catalysis,2017,38(2):348-356.
