燃煤烟气污染物SO2,NOx和粉尘排放指标具有严格的环保标准[1-2]。目前多数电厂采用烟气湿法脱硫(WFGD)脱除SO2,采用催化还原(SCR)脱除NOx[3-4]。这些技术已经相对成熟,被认为是解决烟气污染物最有效的方法。然而,除去投资和运营成本之外,这些技术在运行中出现了一些问题,如受热面积积灰腐蚀严重等。燃煤污染物低成本高效脱除技术一直是能源领域的研究重点之一。
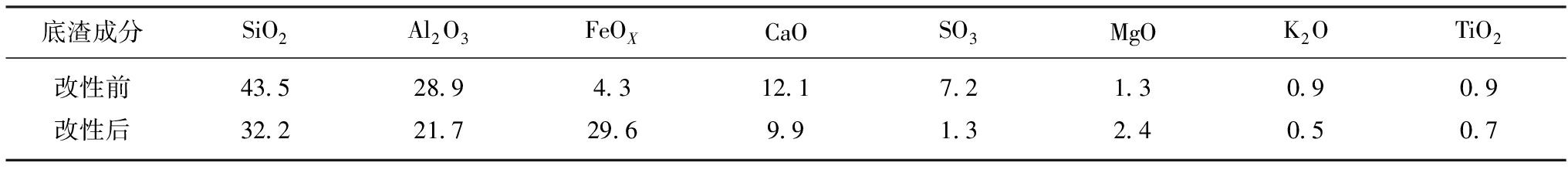
底渣主要由SiO2,Al2O3,Fe2O3和CaO等成分组成[5]。作为燃煤电厂的主要固体废弃物之一,其有效利用及处理对于电厂的循环经济有着重要的影响。底渣是煤粉高温燃烧后的产物,具有热稳定性高,比表面积大的特点,成为了良好的催化剂载体[6]。此外,底渣中的FeOX是Fenton反应的优良催化剂。
目前,在非均相类Fenton体系中,大多数研究使用加热法汽化固定床系统中的H2O2溶液。然而,由于蠕动泵的不连续性以及泵出口液滴尺寸较大,使得H2O2液滴很难在加热器中立即汽化,造成H2O2溶液高温自分解产生O2和H2O,影响H2O2溶液的使用效率。本研究采用超声雾化器将H2O2溶液变成直径约10 μm的小液滴,降低H2O2溶液的自分解,有效的利用了H2O2溶液。
笔者以电厂底渣为对象,通过球磨、磁选、碱改性的方法制备出一种固体底渣催化剂,结合类Fenton体系,在自主设计的实验台上开展了NO的脱除研究。对比不同条件下改性催化剂的活性,为获得高效廉价的非均相类Fenton催化剂提供理论基础;也为非均相类Fenton技术脱除大型燃煤电厂烟气中的NOx提供新的技术途径。实现电厂“以废治污”的目标。
1 实验装置与方法
1.1 实验装置与流程
非均相类Fenton体系脱除NO实验在自主设计的固定床实验平台上进行。实际系统如图1所示。

图1 固定床实验系统
Fig.1 Fixed bed reactor system
1—冷却水槽;2—雾化器;3—水泵;4—管式炉;5—催化剂;6—石英管
由模拟烟气、质量流量计、混合气室、反应器、雾化装置、烟气分析仪以及尾气处理装置等组成。模拟烟气由N2,NO,SO2混合组成,总气量为300 mL/min,其中有一组N2为雾化装置的载气,流量为60 mL/min。NO和SO2的体积分数均为500×10-6。采用质量浓度为30%的H2O2溶液分别配制质量浓度为2%,4%,6%,8%和10%的H2O2溶液。溶液通过蠕动泵加入到雾化装置,在载气的携带下一同进入反应器并在催化剂的表面分解产生·OH自由基,NO被产生的·OH自由基氧化,产物被Ca(OH)2溶液吸收。反应温度由管式炉温度控制器调节。实验时催化剂的用量为0.5 g。反应后尾气通过烟气分析仪进行检测,剩余尾气在排入大气前被浓H2SO4/KMnO4混合液以及活性炭吸收。
1.2 催化剂制备
实验用底渣灰采集自某200 MW循环流化床机组,其成分分析见表1。将底渣与Ca(OH)2以5∶1的质量比混合,加入500 mL去离子水,以500 r/min的速度球磨5 h。球磨后的混合浆液磁选2次,分离出磁性物质过滤清洗直至pH为7,然后干燥。改性前的底渣命名为RBA,改性后的底渣为MBA。
表1 改性底渣灰成分分析
Table 1 Modified bottom ash composition analysis %
底渣成分SiO2Al2O3FeOXCaOSO3MgOK2OTiO2改性前43.528.94.312.17.21.30.90.9改性后32.221.729.69.91.32.40.50.7
1.3 数据分析方法
NO的脱除效率在反应稳定1 h后测量,计算公式为
η=(Ci-Co)/Ci×100%
(1)
式中,η为NO的脱除效率;Ci和Co分别为反应器进口和出口的NO体积分数,10-6。
1.4 催化剂表征方法
采用X射线荧光光谱分析仪(XRF)测定底渣灰中各成分的含量;X射线衍射仪(XRD)分析底渣催化剂晶型;扫描电子显微镜(SEM)观察催化剂的微观形貌;傅氏转换红外线光谱分析仪(FTIR)检测催化剂表面官能团。
采用德国Bruker X-Band A 200 型电子顺磁共振光谱仪(ESR)验证反应过程中中间体·OH自由基的产生。其原理是在类 Fenton 反应过程中使用DMPO(5,5-二甲基-1-吡咯啉-N-氧化物)捕获剂与·OH自由基结合,形成相对稳定的自旋加合物DMPO-OH,通过ESR测定DMPO-OH的信号强度来间接测定·OH的浓度。实验时,取一定量0.1 g底渣与10 mL质量分数6%的H2O2溶液在80 ℃条件下反应产生的类Fenton反应液,加入2 mL物质的量浓度为0.2 mol/L的DMPO捕获剂,充分反应后利用ESR检测DMPO-OH的峰值强度[7]。
2 结果与讨论
2.1 催化剂表征
2.1.1 XRF
表1给出了改性后的底渣各成分的含量,与原渣的成分含量相比,FeOX的含量在改性之后明显的增长,达到29.6%,SiO2,Al2O3和CaO的含量都有一定程度的下降。主要由于两次湿法磁选使FeOX得到富集,含量显著增加,而没有磁性的成分则相对下降。
2.1.2 XRD
图2给出了底渣在改性前后的晶型对比,原渣中主要晶体为石英和CaSO4。由图2可知,经改性后石英的峰强明显减小,主要因为碱改性过程造成Al—O和Si—O结构电荷分布变化,破坏了底渣外壳的Al—O和Si—O的化学键[8]。在碱改性底渣中出现了更多Fe3O4相,由于两次湿法磁选使得更多磁性铁氧化物得到富集,另外碱对底渣表面硅铝结构破坏,使更多的铁氧化物暴露出来。碱改性后的底渣中并未发现Fe2O3的峰,可能是大部分Fe2O3没有磁性,不能通过磁选方式分选。

图2 底渣灰催化剂XRD谱
Fig.2 XRD patterns of bottom ash catalyst
2.1.3 SEM
图3为原渣和改性底渣催化剂的SEM形貌。图3(a)可以看出原渣多数为不规则颗粒的聚集体,颗粒较大且表面附着一些小颗粒。图3(b)为原渣表面放大图,表面虽凹凸不平但相对光滑。图3(c)和3(d)为碱改性后底渣表面,与原渣表面相比更加粗糙,出现了小颗粒状,这也说明碱改性严重破坏了底渣表面的硅铝结构,使得内部的铁氧化物暴露出来,有利于类Fenton反应的进行。

图3 底渣灰催化剂SEM图
Fig.3 SEM pictures of bottom ash catalyst
2.1.4 FITR
图4为原渣和改性底渣催化剂的FITR图谱。从图中可以看出3 440 cm-1处两者均有吸收峰,该吸收峰主要是水和表面羟基的O—H键的伸缩振动[9],但改性渣的强度较高,由此推测改性渣表面羟基含量高于原渣;1 441 cm-1处的吸收峰为![]() 改性后的强度明显高于改性前的强度,可能的原因是碱改性过程中,空气中的二氧化碳溶于碱液,提高了
改性后的强度明显高于改性前的强度,可能的原因是碱改性过程中,空气中的二氧化碳溶于碱液,提高了![]() 含量[9];1 080 cm-1处为Si—O—T(T
含量[9];1 080 cm-1处为Si—O—T(T![]() Si或Al)在TO4四面体里的不对称伸缩振动[10];876 cm-1处为Fe—O—H在FeOOH里的伸缩振动[11],改性后的强度高于改性前,说明改性后底渣中FeOOH的含量高于改性前;在566 cm-1和488 cm-1处较弱的峰为铁氧化物中Fe—O的伸缩振动[12],改性后强度明显高于改性前,改性后底渣中铁氧化物的含量明显高于改性前,这与XRF所得的结论一致。
Si或Al)在TO4四面体里的不对称伸缩振动[10];876 cm-1处为Fe—O—H在FeOOH里的伸缩振动[11],改性后的强度高于改性前,说明改性后底渣中FeOOH的含量高于改性前;在566 cm-1和488 cm-1处较弱的峰为铁氧化物中Fe—O的伸缩振动[12],改性后强度明显高于改性前,改性后底渣中铁氧化物的含量明显高于改性前,这与XRF所得的结论一致。

图4 底渣灰催化剂FTIR图谱
Fig.4 FTIR patterns of bottom ash catalyst
2.2 NO脱除实验
2.2.1 反应温度和SO2对于催化剂性能的影响
反应温度是影响催化反应速率的一个重要因素。图5为反应温度对于NO脱除效率的影响,反应条件为H2O2质量分数6%,催化剂0.5 g,气体流量300 mL/min,NO体积分数500×10-6,SO2体积分数500×10-6。在原渣与H2O2溶液的反应体系中,NO的脱除效率随着温度的升高先升高后降低,在80 ℃时达到最高,为45%。在改性渣催化剂与6%的H2O2溶液未通SO2的体系中,采用原渣和改性渣催化H2O2溶液脱除NO时,脱除效率均随温度的升高而升高,且均在80 ℃左右达到最佳脱除效率,但改性渣的脱除效果远优于原渣。NO的脱除是一个非常复杂的过程,涉及一系列化学反应。根据阿累尼乌斯定律,温度的提高对于反应速率的提高有促进作用[13],这也是温度从40 ℃提高到80 ℃时NO脱除效率提高的主要原因之一。在无SO2的情况下,当反应温度大于80 ℃时,NO脱除效率逐渐下降,主要是在该氛围下催化分解H2O2溶液产生·OH自由基与H2O2溶液分解为H2O和O2的过程达到一个平衡,继续升高温度使H2O2溶液分解为H2O和O2的反应占据优势,而O2氧化NO的能力远低于·OH自由基[14]。

图5 反应温度对脱除NO的影响
Fig.5 Effect of temperature on NO removal
在通入SO2的反应体系中,NO脱除的最佳温度为140 ℃。在温度小于140 ℃时,NO脱除效率随着温度的升高而升高,但温度小于100 ℃时,NO的脱除效率比之前未通SO2的体系中的效率低,可能因为在低温区SO2被氧化为![]() 液相的
液相的![]() 与Ca2+附着在催化剂表面,反应生成CaSO4沉淀阻塞了催化剂表面的孔道,从而阻碍了反应进行;当温度大于100 ℃时反应变为气固反应,由于SO2和CaO气固反应最佳温度为800 ℃左右,在该实验温度区间(40~160 ℃)内只有极少量的CaSO4生成,另外气体流动性要远大于附着在催化剂表面的液体,以及后续气体的推动作用,使生成的SO3与CaO反应时间减少,导致形成的CaSO4的量比液相时大大减少,孔道阻塞相对减小[15]。在120~160 ℃,该体系中NO的脱除效率远高于之前未通SO2的体系,可能因为SO2使得催化剂周围变成酸性氛围,该氛围对H2O2被催化分解为·OH自由基起促进作用[16],尤其是H2O2蒸汽。但温度继续升高NO脱除效率降低,可能因为H2O2自身大量分解为O2和H2O,对于NO的氧化作用降低。
与Ca2+附着在催化剂表面,反应生成CaSO4沉淀阻塞了催化剂表面的孔道,从而阻碍了反应进行;当温度大于100 ℃时反应变为气固反应,由于SO2和CaO气固反应最佳温度为800 ℃左右,在该实验温度区间(40~160 ℃)内只有极少量的CaSO4生成,另外气体流动性要远大于附着在催化剂表面的液体,以及后续气体的推动作用,使生成的SO3与CaO反应时间减少,导致形成的CaSO4的量比液相时大大减少,孔道阻塞相对减小[15]。在120~160 ℃,该体系中NO的脱除效率远高于之前未通SO2的体系,可能因为SO2使得催化剂周围变成酸性氛围,该氛围对H2O2被催化分解为·OH自由基起促进作用[16],尤其是H2O2蒸汽。但温度继续升高NO脱除效率降低,可能因为H2O2自身大量分解为O2和H2O,对于NO的氧化作用降低。
2.2.2 H2O2浓度对于催化剂性能的影响
H2O2溶液是强氧化性物质·OH自由基的来源,它的质量分数对于NO的脱除起着至关重要的作用。图6为H2O2的质量分数对NO脱除的影响,反应条件为催化剂0.5 g,气体流量300 mL/min,NO体积分数500×10-6,反应温度为80 ℃。由图可知,随着H2O2质量分数的提高,类Fenton体系脱除NO的效率也在提高。仅H2O2溶液已起到脱除NO的作用,当H2O2质量分数为10%时脱除效率可以达到45%;原渣在反应中起到了一定的催化作用,主要是因为原渣中含有FeOX,但由于含量较低催化作用不太明显,导致NO脱除效率在H2O2质量分数达到10%时只有50%;改性底渣在反应中起到的非常明显的催化作用,在H2O2质量分数为6%时,NO的脱除效率已达86%。H2O2质量分数提高到8%之后,NO的脱除效率维持稳定可达到90%以上。但继续提高H2O2浓度降低经济性,所以本实验选用质量分数为6%的H2O2溶液。

图6 H2O2质量浓度对NO脱除的影响
Fig.6 Effect of H2O2 quality concentration on NO removal
在改性渣反应体系中,当H2O2质量分数较低时,增加H2O2质量分数可以使得更多H2O2分子吸附在催化剂的表面,从而催化H2O2分解产生更多的·OH自由基。当H2O2浓度过高时,催化剂表面吸附分子达到饱和状态,虽然有催化分解但不能产生更多的·OH自由基[7]。因此对脱除NO时,H2O2溶液浓度需控制在合理范围内。
2.2.3 NO体积分数对于催化剂性能的影响
NO体积分数是影响NO脱除效率的重要因素,也是分析催化剂性能的关键指标。图7为NO浓度对NO脱除效率的影响,反应条件为H2O2质量分数6%,催化剂0.5 g,气体流量300 mL/min,NO体积分数500×10-6,反应温度80 ℃。由图可知,随着NO体积分数的升高,原渣和改性渣反应体系中的NO脱除效率都在降低,这符合正常的规律。随着NO体积分数的升高,H2O2和NO的摩尔比逐渐减小。因此,一定量的H2O2催化分解产生的·OH自由基不足以氧化更多的NO,所以烟气污染物中NO的脱除效率降低。

图7 NO体积分数对脱除NO的影响
Fig.7 Effect of NO volume fraction on NO removal
2.2.4 催化剂性能的稳定性
催化剂的稳定性对于烟气污染物的脱除十分关键,而且在工业应用中稳定性也是需要考察的一个关键指标。本文进行了长时间的实验(反应条件为H2O2质量分数6%,催化剂0.5 g,气体流量300 mL/min,NO体积分数500×10-6;温度为80 ℃)来验证催化剂的稳定性结果如图8所示,随着时间的增加,NO的脱除效率几乎不变,在20 h的实验后,脱除效率仍可达到81%以上,这已经达到了工业应用的标准。

图8 催化剂的稳定性测试
Fig.8 Stability test of catalyst
2.3 改性底渣催化H2O2脱除NO机理分析
非均相类Fenton体系脱除NO的反应主要包括两个步骤:一是经雾化装置和载气携带的H2O2与非均相催化剂接触,在催化剂表面分解,产生具有强氧化性的·OH自由基;二是具有强氧化性的·OH与烟气中的NO接触将NO氧化为溶解性更大的NO2,然后被后置的吸收液吸收[7]。图9为类Fenton反应中ESR波谱的图形,对比了H2O2在原渣与改性渣催化下的峰值强度。由图9可见测得的图谱均为典型的四重峰曲线,他们的峰值强比为1∶2∶2∶1,两种物质产生的峰均符合DMPO-OH加合物的ESR特征峰,这也证明了反应体系中确实有·OH自由基的生成。从ESR的曲线峰值强度来看,碱改性底渣催化剂的强度明显高于原渣的强度,说明改性底渣催化剂对于H2O2分解产生·OH的能力远远强于原渣。在本实验中原渣与改性渣类Fenton体系脱除NO的性能的巨大差异,主要源于催化反应过程中产生·OH自由基的能力。

图9 原渣和改性渣在类Fenton反应中的ESR波谱强度
Fig.9 ESR spectrum of RBA and MBA in Fenton-like reactions

图10 自由基抑制剂对NO脱除效率的影响
Fig.10 Effect of free radical inhibitor on NO removal efficiency
为了进一步验证·OH自由基对NO的氧化脱除作用,进行了抑制·OH自由基的NO脱除实验。在配好的H2O2溶液中加入一定量的异丙醇(IP)(·OH自由基的抑制剂)。实验结果如图10所示,在未加入异丙醇(IP)的实验体系中,NO的脱除效率可以维持在86%左右,在加入异丙醇(IP)之后,脱除效率仅为40%左右,但比6%的H2O2溶液脱除效率要高。主要原因是在该反应中·OH自由基是氧化NO的关键氧化物,但异丙醇的添加使得·OH自由基的的生成受到抑制生成了更多的·HO2(1.6 eV),它的氧化性要低于·OH自由基(2.8 eV)但是高于H2O2[14]。这证明了·OH自由基确实是该实验系统中氧化NO的关键因素,也解释了抑制·OH自由基后的脱除效率依旧高于单纯质量分数6%的H2O2溶液脱除效率的原因。
根据实验结果,本文分析改性底渣催化H2O2脱除NO的反应机理为
H2O2分解产生·OH自由基[16-17]:
Fe(Ⅲ)+H2O2![]() Fe(Ⅱ)+·HO2+H+
Fe(Ⅱ)+·HO2+H+
(2)
Fe(Ⅲ)+·HO2![]() Fe(Ⅱ)+O2+H+
Fe(Ⅱ)+O2+H+
(3)
Fe(Ⅱ)+H2O2![]() Fe(Ⅲ)+OH-+·OH
Fe(Ⅲ)+OH-+·OH
(4)
·OH自由基氧化脱除NO[18-20] :
NO+·OH![]() HNO2
HNO2
(5)
NO+·OH![]() NO2+H·
NO2+H·
(6)
NO2+·OH![]() HNO3+H·
HNO3+H·
(7)
HNO2+·OH![]() HNO3+H·
HNO3+H·
(8)
NOx被Ca(OH)2溶液吸收:
Ca(OH)2+2N(III)/N(IV)![]() Ca(NO2)2+H2O
Ca(NO2)2+H2O
(9)
Ca(OH)2+2N(V)![]() Ca(NO3)2+H2O
Ca(NO3)2+H2O
(10)
3 结 论
(1)采用碱-磁改性方式对底渣处理后制成的非均相类Fenton催化剂具有很好的催化性能。在最佳条件下NO脱除效率可以达到86%,远高于原渣的催化脱除效率。
(2)反应温度、H2O2溶液浓度、NO浓度和SO2对NO的脱除有很大的影响。
(3)通过ESR技术验证了改性底渣作为催化剂可以促进H2O2分解产生大量强氧化性的·OH自由基,其是脱除NO的决定性因素。
[1] LIU Yangxian,WANG Qian,PAN Jianfen.Novel process of simultaneous removal of nitric oxide and sulfur dioxide using a vacuum ultraviolet (VUV)-activated O2/H2O/H2O2 system in a wet VUV-spraying reactor[J].Environmental Science & Technology,2016,50(23):12966.
[2] ZHAO Yi,HAN Ying,GUO Tian.Simultaneous removal of SO2 and NO from flue gas using multicomposite active absorbent[J].Industrial & Engineering Chemistry Research,2012,51(1):480-486.
[3] WU Bo,XIONG Yuanquan,RU Jing,et al.Enhancement of NO absorption in ammonium-based solution using heterogeneous Fenton reaction at low H2O2,consumption[J].Korean Journal of Chemical Engineering,2016,33(12):3407-3416.
[4] ZHAO Yi,HAO Runlon,WANG Tianhao,et al.Follow-up research for integrative process of pre-oxidation and post-absorption cleaning flue gas:Absorption of NO2,NO and SO2[J].Chemical Engineering Journal,2015,273:55-65.
[5] PRINYA Chindaprasirt,CHAI Jaturapitakkul,WICHIAN Chalee,et al.Comparative study on the characteristics of fly ash and bottom ash geopolymers[J].Waste Management,2009,29(2):539-543.
[6] WANG Shaobin.Application of solid ash based catalysts in heterogeneous catalysis[J].Environmental Science & Technology,2008,42(19):7055-7063.
[7] 周长松,孙路石,张安超,等.非均相类Fenton催化剂脱汞的实验与机理[J].化工学报,2015,66(4):1324-1330.
ZHOU Changsong,SUN Lushi,ZHANG Anchao,et al.Experimental and mechanism of mercury removal from heterogeneous Fenton catalyst[J].Acta Chemica Sinica,2015,66(4):1324-1330.
[8] ZHOU Lin,CHEN Yunlin,ZHANG Xinghua,et al.Zeolites developed from mixed alkali modified coal fly ash for adsorption of volatile organic compounds[J].Materials Letters,2014,119(11):140-142.
[9] ELIZALDEGONZLEZ Mara P,MATTUSCH Jrgen,WENNRICH Rainer,et al.Uptake of arsenite and arsenate by clinoptilolite-rich tuffs[J].Microporous & Mesoporous Materials,2001,46(2):277-286.
[10] FERN NDEZ-Jiménez A,PALOMO A.Composition and microstructure of alkali activated fly ash binder:Effect of the activator[J].Cement & Concrete Research,2005,35(10):1984-1992.
NDEZ-Jiménez A,PALOMO A.Composition and microstructure of alkali activated fly ash binder:Effect of the activator[J].Cement & Concrete Research,2005,35(10):1984-1992.
[11] GAO Cunxu,LIU Qingfang,XUE Desheng.Preparation and characterization of amorphous beta-FeOOH nanowire arrays[J].Journal of Materialsence Letters,2002,21(22):1781-1783.
[12] RENDON Jose L.IR spectra of powder hematite:Effects of particle size and shape[J].Clay Minerals,1981,16(4):375-382.
[13] WU Bo,XIONG Yuanquan,RU Jing,et al.Enhancement of NO absorption in ammonium-based solution using heterogeneous Fenton reaction at low H2O2,consumption[J].Korean Journal of Chemical Engineering,2016,33(12):3407-3416.
[14] WU Bo,XIONG Yunaquan,GE Y.Simultaneous removal of SO2 and NO from flue gas with OH from the catalytic decomposition of gas-phase H2O2 over solid-phase Fe2(SO4)3[J].Chemical Engineering Journal,2017:S1385894717314389.
[15] 王世昌,徐旭常,姚强.水蒸汽对CaO颗粒脱硫反应催化作用的实验研究[J].中国电机工程学报,2004,24(9):252-256.
WANG Shichang,XU Xuchang,YAO Qiang.Experimental study on catalytic effect of steam on desulfurization of CaO particles[J].Chinese Journal of Electrical Engineering,2004,24(9):252-256.
[16] DING Jie,ZHONG Qin,ZHANG Shule,et al.Simultaneous removal of NOx,and SO2,from coal-fired flue gas by catalytic oxidation-removal process with H2O2[J].Chemical Engineering Journal,2014,243(5):176-182.
[17] PHAM ANH LE-TUAN,LEE Changha,DOYLE Fiona M,et al.A Silica-supported iron oxide catalyst capable of activating hydrogen peroxide at neutral pH values[J].Environmental Science & Technology,2009,43(23):8930-8935.
[18] DAVID R Hanson,JAMES B Burkholder,CARLETON J Howard,et al.Measurement of OH and HO2 radical uptake coefficients on water and sulfuric acid surfaces[J].The Journal of Physical Chemistry,1992,96(12):4979-4985.
[19] CZAPSKI G,GOLDSTEIN S.The role of the reactions of NO with superoxide and oxygen in biological systems:A kinetic approach[J].Free Radical Biology & Medicine,1995,19(6):785-794.
[20] DING Jie,ZHONG Qin,ZHANG Shule.Simultaneous desulfurization and denitrification of flue gas by catalytic ozonation over Ce-Ti catalyst[J].Fuel Processing Technology,2014,128:449-455.
