汞是继氮氧化物、二氧化硫及粉尘之后的第4种污染物,汞具有高毒性、高挥发性、生物体内富集等特点,能够对人体造成极大的危害,因此已引起国内外学者的广泛关注[1-3]。燃煤烟气中的汞主要分为3种,一种是经过氧化后形成的二价汞(Hg2+),一种是附着在飞灰上面的颗粒汞(HgP),最后一种是单质汞(Hg0)[3-7]。Hg2+易溶于水,可以通过湿法脱硫装置进行脱除,HgP可以被电除尘器脱除。然而对于Hg0,由于其极易挥发、化学性质稳定且水溶性差等特点很难被现有环保设备捕获而排入大气[8-10]。因此,如何经济高效地捕捉Hg0成为汞污染控制的研究方向。
现有的Hg0吸附技术也是现阶段探索的热点,钙基类吸附剂主要对Hg2+的吸附率较高,容易获取,而且价格低廉,同时又是脱除烟气中SO2的有效脱硫剂,但是对Hg0的吸附率较低[11]。电厂自身具备飞灰吸附剂,不需要再次购买,但是吸附效率较低,探索者通常尝试改性飞灰可以提高吸附率而增加成本[12]。活性炭吸附Hg0在国内外广泛的应用,主要因为活性炭具有高的比表面积,发达的孔隙结构,对NOx,SO2,Hg0都有较好吸附性能,但是活性炭运行成本高,限制了大规模应用[13-16]。因此开发廉价高效的吸附剂来代替活性炭是可行的途径。活性焦是通过褐煤热解后进一步活化得到的产物,由于活性焦尚未热解完全内部含有较多的氢、氧官能团,有较丰富的孔隙及表面结构,同时活性焦具有负载性和氧化性,是一种理想的烟气净化剂,并且价格相对便宜,对Hg0有很好的吸附效果[17-19]。因此,活性焦具有很好的应用前景和经济效益。
笔者利用准东褐煤为原料通过一步法对煤粉进行炭化活化制备活性焦,并对不同工况下制备的活性焦进行脱Hg0性能实验研究,分析活性焦吸附Hg0的变化趋势及影响活性焦吸附性能的主要因素。进一步通过不同条件的解吸实验探索活性焦解吸及原位活化性能。
实验采用准东褐煤为粉焦制备的原料,其工业分析和元素分析见表1。取一定量的煤粉放入干燥箱中,在110 ℃条件下干燥8 h,进而对干燥后煤粉进行破碎、筛分,选取250~160目(平均粒径75 μm)煤粉颗粒作为粉焦制备的原材料。图1 是粉状活性焦制备装置及系统,主要构成部分包括微型给料机、配气系统、水蒸气发生系统、控温系统和活性焦制备系统。配气系统由高纯N2、高纯O2、高纯CO2组成。微型给料机为Sankyo Piotech公司的MFEV-1VO型Microfeeder给料机,采用N2携带方式实现连续均匀给料。水蒸汽发生系统通过N2携带水蒸气后一同进入沉降炉反应器。沉降炉反应器为保证加热均匀,采用上、下两段分段加热,由程序控温系统控制。冷却阶段通过循环水冷却,实验过量氧气系数(氧/煤当量比)为0.4,具体实验通过如表2所示的工况获得炭化(TH),停留时间5 s、炭化后活化(TH-HH)碳化阶段停留时间5 s,活化阶段停留时间5 s、炭化活化一步(THHH)样品,停留时间5 s。表3是TH,TH-HH 和THHH样品的工业分析、元素分析及对应的原煤烧失率。
表1 原煤工业分析和元素分析
Table 1 Proximate and ultimate analyses of coal %
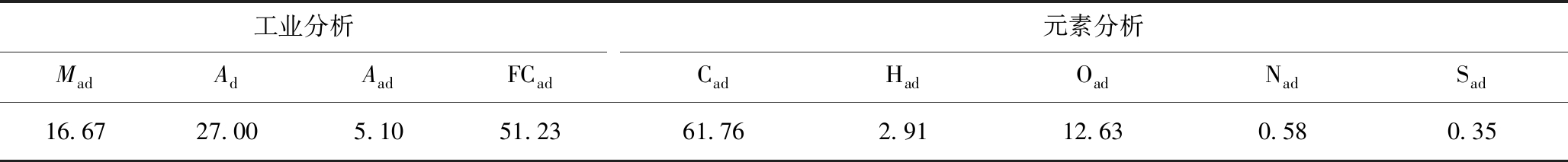
工业分析MadAdAadFCad元素分析CadHadOadNadSad16.6727.005.1051.2361.762.9112.630.580.35
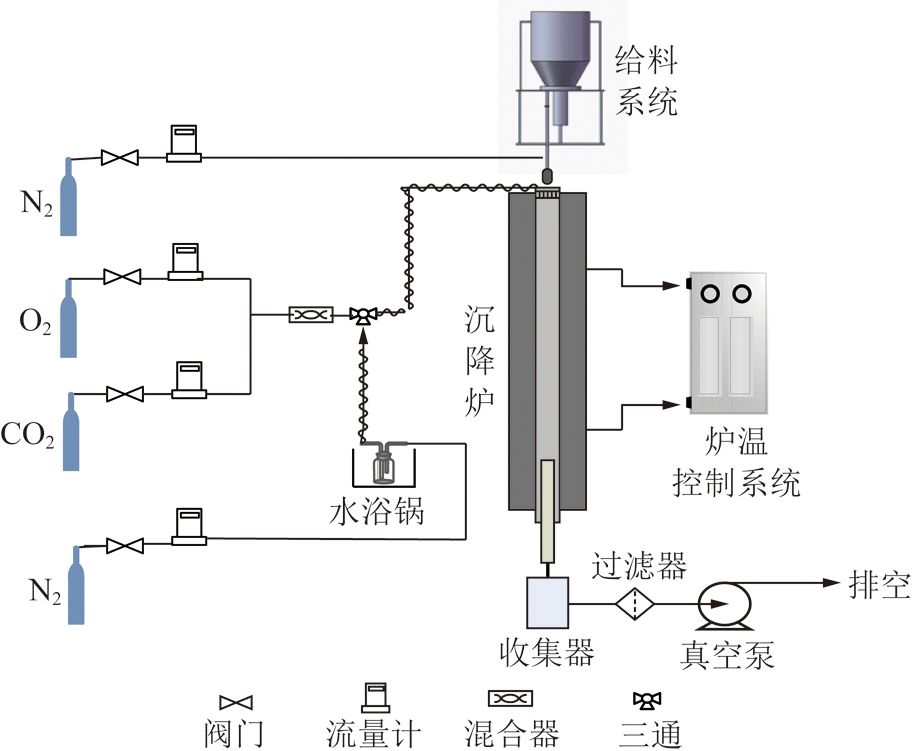
图1 粉焦制备实验装置系统
Fig.1 System of powder activated coke preparation
如图2所示,实验通过固定床吸附系统对活性焦吸附Hg0性能进行评价,主要包括程序控温系统、Hg0的发生系统和检测系统。在每次试验中,将1 mL 制备的活性焦样品装入反应器,置于程序控温管式炉的中心。Hg0渗透管放入U形玻璃管中并置入水浴锅中,通过调节载Hg0氮气及水浴锅温度控制Hg0的质量浓度(45±0.5 μg/m3),Hg质量浓度由Thermo Fisher公司生产的CEMS i连续监测系统检测,Hg连续监测系统可以实现烟气中不同形态Hg质量浓度的测量。通过质量流量控制器控制O2,SO2,H2O等模拟气体以稳定速度注入混合器。试验的总流速保持在1 L/min,即计算空速为15 000/h。在每次试验中,汞入口Hg0质量浓度由旁路确定![]() 出口质量浓度由Hg0通过反应床后确定
出口质量浓度由Hg0通过反应床后确定![]() 吸附效率根据式(1)计算:
吸附效率根据式(1)计算:
(1)
表2 粉焦制备工况参数
Table 2 Performance parameter of activated coke preparation

样品给料量/(kg·min-1)反应温度/℃给料N2/(L·min-1)平衡N2/(L·min-1)12% CO2/(L·min-1)6% O2/(L·min-1)10% H2O(g)/(L·min-1)TH0.002 9195069.89000TH-HH0.002 7195065.441.910.951.59THHH0.002 9195065.441.910.951.59
表3 TH,TH-HH 和THHH样品的工业分析、元素分析及对应的原煤烧失率
Table 3 Proximate and ultimate analyses of coke and burn-off of TH,TH-HH and THHH
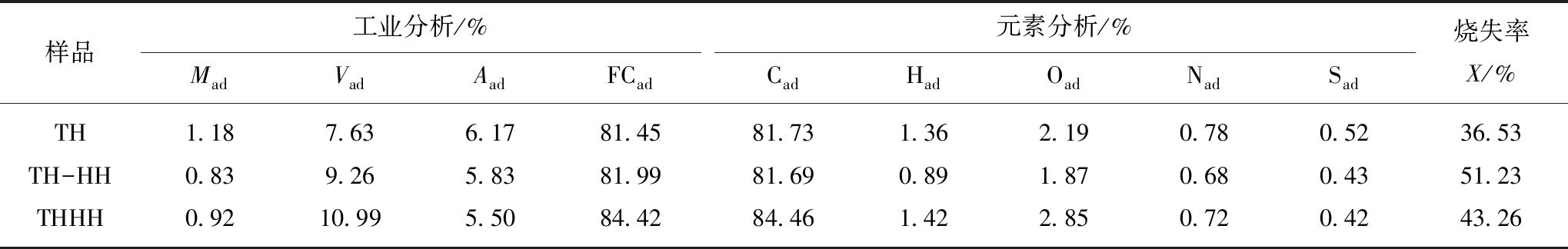
样品工业分析/%MadVadAadFCad元素分析/%CadHadOadNadSad烧失率X/%TH1.187.636.1781.4581.731.362.190.780.5236.53TH-HH0.839.265.8381.9981.690.891.870.680.4351.23THHH0.9210.995.5084.4284.461.422.850.720.4243.26

图2 汞吸附系统
Fig.2 Experimental system of Hg0 adsorption
通过扫描电镜(SEM:DESK V)对样品的表面形貌进行了表征,样品用PerkinElmer FTIR 2000进行官能团的分析。用VG Multilab 2000 X-射线光电子谱仪分析样品X-射线光电子能谱(XPS),试验数据采用Casa XPS软件中的Gaussian-Lorentzian函数进行拟合。用BET测定吸附剂的比表面积,并通过barrettg-jioner-halenda(BJH)法计算孔隙体积和孔径。

图3 扫描电镜
Fig.3 SEM images
如图3所示,通过扫描电镜分析了原煤、TH、TH-HH、THHH四种样品的表面形貌结构,图3(a)是原煤的形貌,由图3(a)可知原煤表面没有发达的孔隙结构,文献报道发达的孔隙结构能够促进Hg0的吸附[20],因此原煤对Hg0的吸附微乎其微。图3(b)可以看出在炭化过程中活性焦表面开始有细微的孔隙出现,但由于孔隙的含量很少,因此对Hg0的吸附性能受到限制。如图3(c)所示,从表面结构上可以看出活性焦表面出现了大量的孔隙结构,这将有利于Hg0的吸附。对比图3可以看出图3(d)形成了发达的孔隙结构,并且具有更多的介孔、微孔结构,因此THHH具有较高的Hg0吸附性能。进一步通过BET分析了样品表面的孔隙结构及比表面积,表4通过4个样品的BET对比分析表明;THHH制备的活性焦具有较大的比表面积、总孔容及合适的孔径大小,这将有利于活性焦对Hg0的吸附。因此,BET的结果与扫描电镜图观察的表面形貌的结果是一致的。
表4 原煤、TH、TH-HH、THHH样品微观结构参数
Table 4 Microstructural parameters of raw coal,TH,TH-HH,THHH
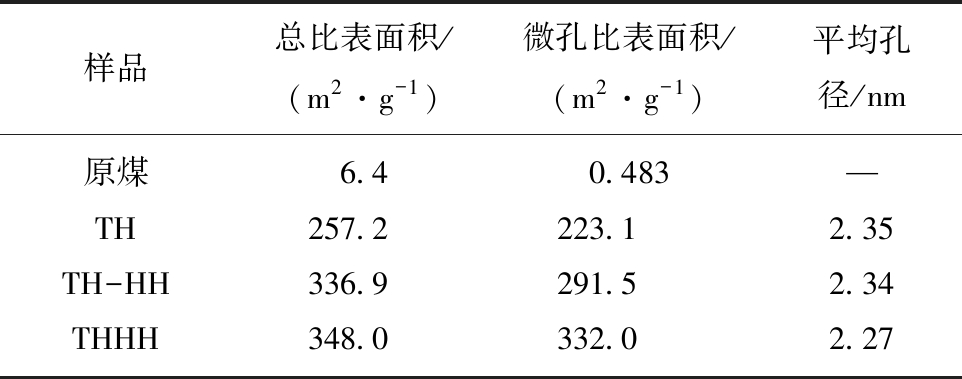
样品总比表面积/(m2·g-1)微孔比表面积/(m2·g-1)平均孔径/nm原煤6.40.483—TH257.2223.12.35TH-HH336.9291.52.34THHH348.0332.02.27
图4为样品THHH,TH-HH,TH,THHH-1的红外光谱图,根据文献可知[21],在 3 600~3 200 cm-1 处是O—H的振动峰,3 000~2 800 cm-1是脂肪族C—H官能团(2 960 cm-1 —CH3,2 875 cm-1 —CH2)的振动峰,2 300~2 400 cm-1处是CO2的物理吸附形成的特征峰。1 700~1 435 cm-1是羰基、半醌基和羧基(C![]() O)和内酯基(O—C
O)和内酯基(O—C![]() O)振动峰。1 200~1 000 cm-1是乙醚、酸酐的C—O的振动峰。通过峰强度比较[22],THHH与TH-HH相比于TH含有更多的羰基、半醌基和内酯基,并且羰基、半醌基和内酯基促进汞的吸附[23],进而使THHH-1中的基团的含量减少,可能原因是汞在活性焦表面发生化学吸附消耗了含氧官能团。
O)振动峰。1 200~1 000 cm-1是乙醚、酸酐的C—O的振动峰。通过峰强度比较[22],THHH与TH-HH相比于TH含有更多的羰基、半醌基和内酯基,并且羰基、半醌基和内酯基促进汞的吸附[23],进而使THHH-1中的基团的含量减少,可能原因是汞在活性焦表面发生化学吸附消耗了含氧官能团。

图4 THHH,TH-HH,TH,THHH-1的红外光谱
Fig.4 IR absorption spectra of THHH,TH-HH,TH,THHH-1

图5 XPS光谱
Fig.5 XPS spectra
图5(a)是TH,TH-HH,THHH,THHH-1(THHH样品吸附Hg0)样品XPS的光谱图,通过XPS拟合分峰后出现2个不同的O的峰,结合能在531.3~531.6 eV和532.4~532.7 eV的峰分别被认为酮、内酯、羰基或者醌基(C![]() O)和羟基、酯基、酰胺或者酸酐(C—O)[24]。样品中C
O)和羟基、酯基、酰胺或者酸酐(C—O)[24]。样品中C![]() O和C—O含量的计算结果见表5;TH,TH-HH,THHH的C
O和C—O含量的计算结果见表5;TH,TH-HH,THHH的C![]() O分别为52.09%,53.36%,54.21%,C
O分别为52.09%,53.36%,54.21%,C![]() O/C—O比率分别为1.10,1.14,1.18。THHH中含有较高比例的C
O/C—O比率分别为1.10,1.14,1.18。THHH中含有较高比例的C![]() O,文献[23]报道酮、内酯、羰基或者醌基(C
O,文献[23]报道酮、内酯、羰基或者醌基(C![]() O)有利于活性焦对Hg0的吸附,因此THHH对Hg0的吸附性能大于其它样品吸附性能。在THHH-1样品中C—O含有54.32%,C
O)有利于活性焦对Hg0的吸附,因此THHH对Hg0的吸附性能大于其它样品吸附性能。在THHH-1样品中C—O含有54.32%,C![]() O含有45.68%,C
O含有45.68%,C![]() O/C—O比率为0.84,通过THHH和THHH-1的对比可知;THHH-1的C
O/C—O比率为0.84,通过THHH和THHH-1的对比可知;THHH-1的C![]() O相对于THHH减少了8.53%,说明C
O相对于THHH减少了8.53%,说明C![]() O与一部分Hg0发生了化学反应形成了Hg2+。对THHH-1样品中的Hg进行XPS图谱分析可知(图5(b))结合能在101.9 eV的峰被认为是Hg2+的峰[25],说明系统中的Hg0有一部分被活性焦中的C
O与一部分Hg0发生了化学反应形成了Hg2+。对THHH-1样品中的Hg进行XPS图谱分析可知(图5(b))结合能在101.9 eV的峰被认为是Hg2+的峰[25],说明系统中的Hg0有一部分被活性焦中的C![]() O氧化成了Hg2+形成化学吸附,这与THHH-1中的C
O氧化成了Hg2+形成化学吸附,这与THHH-1中的C![]() O官能团减少是一致的,结合能在102.8 eV的峰可能是Si 2p的峰,Hg0在XPS测试时容易挥发,不容易测出结果。
O官能团减少是一致的,结合能在102.8 eV的峰可能是Si 2p的峰,Hg0在XPS测试时容易挥发,不容易测出结果。
表5 TH,TH-HH,THHH,THHH-1不同形态氧含量
Table 5 Concentration of different type of oxygen (C![]() O,C—O) in TH,TH-HH,THHH,THHH-1
O,C—O) in TH,TH-HH,THHH,THHH-1
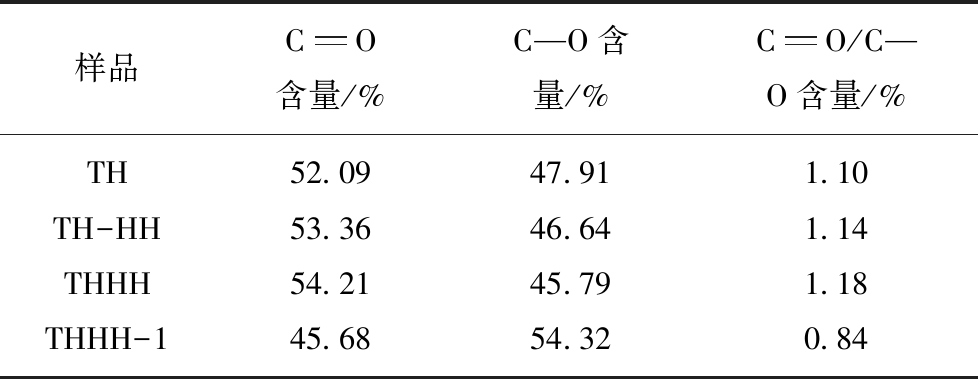
样品CO含量/%C—O含量/%CO/C—O含量/%TH52.0947.911.10TH-HH53.3646.641.14THHH54.2145.791.18THHH-145.6854.320.84
图6为TH,TH-HH,THHH吸附Hg0的穿透曲线,总气量为1 L/min:600×10-6 SO2,6%O2,6%H2O,N2平衡气,T=70 ℃,由图6可知,TH对Hg0具有一定的吸附能力,但是吸附能力比较低,说明经过简单的快速炭化获得的样品表面几乎不能提供Hg0的附着点。TH-HH的穿透曲线相比TH,TH-HH优于TH的吸附性能,说明炭化后再活化产生的孔隙结构为Hg0提供了大量的附着点,进而有利于Hg0的吸附。从样品THHH穿透曲线上看出,一步法制备的活性焦对Hg0的吸附性能明显高于THH-HH。进一步计算TH,TH-HH和THHH 3 h的吸附量分别为3.62,5.41和6.53 μg/g。

图6 Hg0穿透曲线
Fig.6 Breakthrough curves of Hg0
综上所述一步法制备活性焦具有效果好、制备快等优点,这为探索Hg0吸附剂提供简便可行的方法。
如图7所示,THHH在N2气氛下,10 min内对Hg0的最高吸附效率达到45%,随着时间的延长,活性焦对Hg0的吸附作用减弱,120 min后吸附效率只有5%,该样品的吸附方式主要属于物理吸附。在N2中通入6%的O2后,THHH在15 min内平均吸附效率保持在50%以上,最高吸附效率达到75%,随着时间的延长,活性焦吸附效率逐渐降低,120 min后吸附效率维持在20%,说明O2的存在能够促进活性焦对Hg0的吸附。从图7中SO2影响曲线上可以看出N2中添加(0.000 6)%的SO2后,在起初的10 min内最高吸附效率达到70%,该阶段主要是因为活性焦表面有活性氧(O*)的存在与SO2反应生成氧化活性强的SO3附着在活性焦表面,而Hg0与SO3形成化学吸附,随着O*的消耗,化学吸附性能急剧降低,在物理吸附阶段SO2占据吸附位与Hg0在活性焦上吸附过程中存在竞争关系[26],进而导致活性焦对Hg0的吸附性能逐渐降低。因此与N2气氛下吸附性能相比,SO2低于N2气氛对Hg0的吸附性能。进一步分析SO2与O2同时存在时,开始10 min内都保持较高的吸附性能,该阶段主要存在化学吸附性能,随着时间的延长,被消耗的O*与O2补给的氧达到平衡后,活性焦的化学吸附性能逐渐降低,10 min后主要是Hg0在吸附剂表面主要发生了物理吸附。通过上述分析在化学吸附阶段主要有以下公式:
(2)
![]()
(3)
HgO(ads)+SO3![]() HgSO4
HgSO4
(4)
对THHH-1中S的XPS光谱进行拟合分峰,如图8所示,结合能在168.3 eV对应![]() 基团169.5 eV可能对应
基团169.5 eV可能对应![]() 基团[27]。说明有SO2与O2的存在时在活性焦上有
基团[27]。说明有SO2与O2的存在时在活性焦上有![]() 的生成。
的生成。
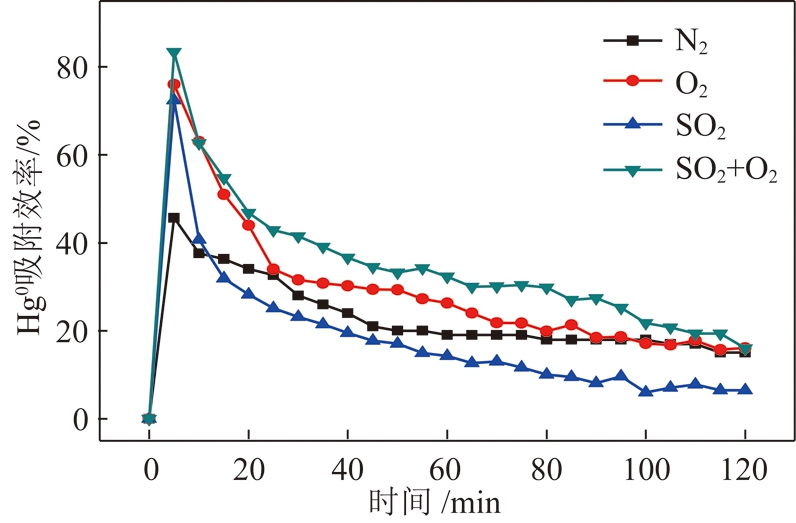
图7 O2和SO2对Hg0脱除效率的影响
Fig.7 Influence of O2 and SO2 on removal of Hg0 on THHH

图8 THHH-1中S 2p的XPS光谱
Fig.8 XPS spectra of S 2p for THHH-1
对THHH-1(THHH吸附2 h后的活性焦及乏焦)分别通过高温和微波方法进行解吸研究。高温解吸温度和微波解吸功率分别为300 ℃和400 W,N2流量为500 mL/min。 如图9(a)所示,在加热到15 min后释放量达到最大值,随着时间的增加释放量逐渐减下,释放速率逐渐趋于平缓,该温度段释放的Hg0属于物理吸附。如图9(b)所示,微波加热5 min释放质量分数达到最大值,随着时间的增加10 min时又有释放峰出现,进一步分析,微波对活性焦进行了快速加热,使释放量很快达到最大值,随着时间的增加,活性焦内部的温度升高,Hg0的释放量再次增加,在解吸曲线上出现了二次增加峰,该峰出现主要是因为活性焦上对Hg0的化学吸附。综上对比两种解吸方式,高温对Hg有好的释放作用,解吸时间长,微波加热的情况下释放的质量分数急剧增加,说明微波可以在短暂的时间内升高温度,将物理吸附和化学吸附的Hg释放出来。

图9 高温(a)、微波(b)下乏焦解吸规律
Fig.9 Hg0 desorption curves under thermal and microwave methods
通过高温和微波2种方法对乏焦进行再生,纯N2气氛、400 ℃下在管式炉中对THHH-1乏焦进行加热2 h,确保乏焦吸附的Hg热解完全,获得高温解析后活性焦(THHH-2)。THHH乏焦放入微波反应器中,通入N2,在400 W条件下解吸60 min,获得微波解吸后活性焦(THHH-3)。对THHH-2,THHH-3进行XPS分析,进一步对不同形态氧计算,结果见表6。THHH-3与THHH相比较,活性焦中C![]() O和C—O变化很小,微波下并不能改变官能团但是能改变活性焦的孔隙结构[28]。THHH-2中的C—O有所增加。对THHH-2,THHH-3进行Hg0二次吸附试验,图10是THHH,THHH-2和THHH-3穿透曲线,其计算吸附量分别为6.53,5.962和7.280 μg/g,从曲线可知,THHH-2略低于THHH的吸附性能,产生差异的主要原因是高温使活性焦孔隙结构发生变化从而抑制了对Hg0的吸附。而THHH-3大于THHH-2和THHH的吸附能力。微波解吸后对活性焦原位活化,进而提高了吸附性能。微波加热使释放出CO的表面含氧官能团分解,在活性焦表面生成活性中心,促进了活性焦对Hg0吸附和催化氧化[28]。通过以上分析,微波解吸后活性焦可促进Hg0二次吸附,高温再生抑制活性焦对Hg0二次吸附。通过对THHH-1和THHH-3样品中Hg的XPS光谱图进行分析,THHH-3样品中的Hg2+峰面积略大于THHH-1中的Hg2+峰面积,进一步说明微波解吸对活性焦进行再次活化,进而促进对Hg0的化学吸附。
O和C—O变化很小,微波下并不能改变官能团但是能改变活性焦的孔隙结构[28]。THHH-2中的C—O有所增加。对THHH-2,THHH-3进行Hg0二次吸附试验,图10是THHH,THHH-2和THHH-3穿透曲线,其计算吸附量分别为6.53,5.962和7.280 μg/g,从曲线可知,THHH-2略低于THHH的吸附性能,产生差异的主要原因是高温使活性焦孔隙结构发生变化从而抑制了对Hg0的吸附。而THHH-3大于THHH-2和THHH的吸附能力。微波解吸后对活性焦原位活化,进而提高了吸附性能。微波加热使释放出CO的表面含氧官能团分解,在活性焦表面生成活性中心,促进了活性焦对Hg0吸附和催化氧化[28]。通过以上分析,微波解吸后活性焦可促进Hg0二次吸附,高温再生抑制活性焦对Hg0二次吸附。通过对THHH-1和THHH-3样品中Hg的XPS光谱图进行分析,THHH-3样品中的Hg2+峰面积略大于THHH-1中的Hg2+峰面积,进一步说明微波解吸对活性焦进行再次活化,进而促进对Hg0的化学吸附。
表6 THHH,THHH-2,THHH-3样品中不同形式氧含量
Table 6 Concentration of different type of oxygen (C![]() O,C—O) in THHH,THHH-2,THHH-3
O,C—O) in THHH,THHH-2,THHH-3
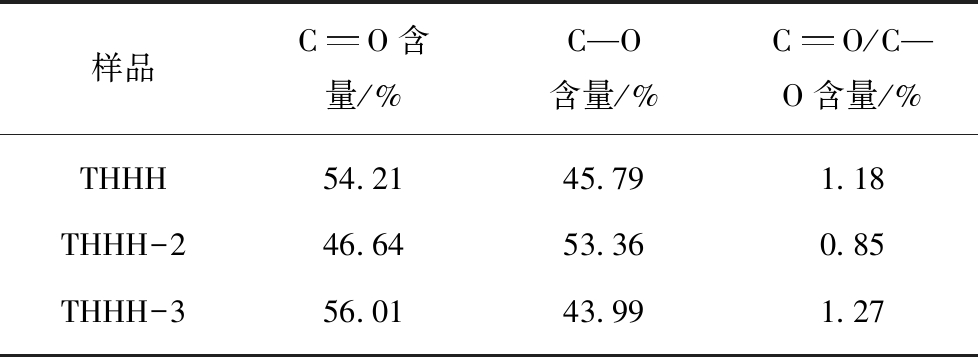
样品CO含量/%C—O含量/%CO/C—O含量/%THHH54.2145.791.18THHH-246.6453.360.85THHH-356.0143.991.27
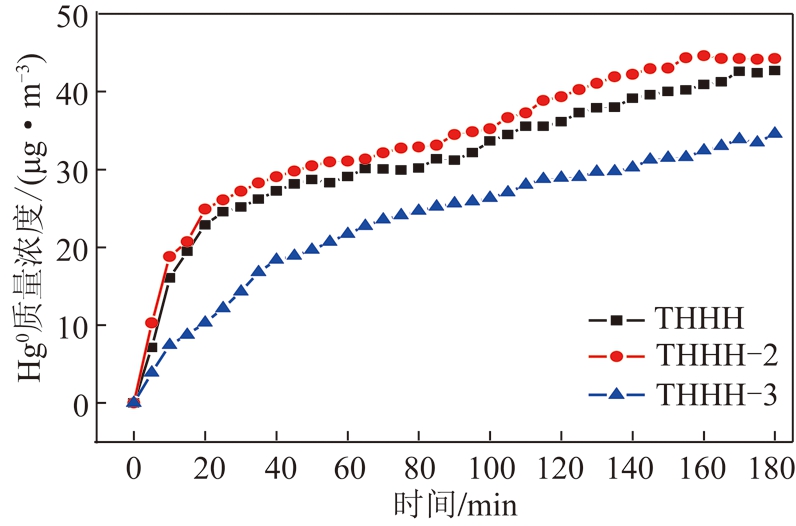
图10 Hg0 在THHH、THHH-2和THHH-3上的穿透曲线
Fig.10 Breakthrough curve of Hg0 over THHH,THHH-2 and THHH-3
(1)采用炭化、两步法、一步法制备活性焦工艺,通过活性焦对Hg0的吸附性能比较,一步法获得的活性焦穿透时间、吸附量均大于其他工况条件下制备的活性焦。
(2)O2在活性焦吸附Hg0中起到促进作用,SO2与Hg0存在竞争关系,进而抑制活性焦对Hg0的吸附,在SO2与O2同时存在时有利于Hg0的吸附。
(3)采用高温加热和微波加热方法对吸附后的乏焦进行解吸,高温后的活性焦二次吸附量有所减弱,微波解吸后的活性焦二次吸附量变大。
(4)采用一步法制备的活性焦,对Hg0的吸附量优于两步法及炭化并且一步法的最大优势在于系统工艺大大简化,投资、运行成本大幅降低,故一步法要明显优于两步法。
[1] PAVLISH J John,HOLMES J Michael,BENSON A Steven,et al.Application of sorbents for mercury control for utilities burning lignite coal[J].Fuel Processing Technology,2003,85(6):563-576.
[2] CHEN Dongyao,ZHAO Songjian,QU Zan,et al.Cu-BTC as a novel material for elemental mercury removal from sintering Gas[J].Fuel,2018,217:297-305.
[3] ZHAO Bin,YI Honghong,TANG Xiaolong,et al.Copper modified activated coke for mercury removal from coal-fired flue gas[J].Chemical Engineering Journal,2016,286:585-593.
[4] WU Shaokang,LI Hailong,LI Liqing,et al.Effects of flue-gas parameters on low temperature NO reduction over a Cu-promoted CeO2-TiO2 catalyst[J].Fuel,2015,159:876-882.
[5] DRISCOLL Charles T,MASON Robert P,et al.Mercury as a global pollutant:Sources,pathways and effects[J].Environmental Science & Technology,2013,47(10):4967-4983.
[6] 丁峰,张军营,赵永椿,等.天然矿物材料吸附剂脱除烟气中单质汞的实验研究[J].中国电机工程学报,2009,29(35):65-70.
DING Feng,ZHANG Junying,ZHAO Yongchun,et al.Experimental study on natural mineral sorbents to remove element mercury in flue gas[J].Proceedings of the CSEE,2009,29(35):65-70.
[7] 华晓宇,周劲松,高翔,等.渗铈活性焦汞脱附性能实验研究[J].中国电机工程学报,2011,31(29):61-66.
HUA Xiaoyu,ZHOU Jinsong,GAO Xiang,et al.Experimental investigation of mercury desorption on CeO2 impregnated activated coke[J].Proceedings of the CSEE,2011,31(29):61-66.
[8] 张斌,侯文慧,范朋慧,等.工艺参数对活性焦烟气中联合脱硫脱汞性能的交互影响[J].煤炭学报,2010,35(9):1548-1552.
ZHANG Bin,HOU Wenhui,FAN Penghui,et al.Interactive effect of operation parameters on the combined removal of SO2 and mercury in flue gas using activated coke[J].Journal of China Coal Society,2010,35(9):1548-1552.
[9] 李阳,朱玉雯,高继慧,等.活性焦孔结构演变规律及对脱硫性能的影响[J].化工学报,2015,66(3):1126-1132.
LI Yang,ZHU Yuwen,GAO Jihui,et al.Activated coke pore structure evolution and its influence on desulfuration[J].Journal of Chemical Industry and Engineering,2015,66(3):1126-1132.
[10] 赵玉冰,郭淼,白中华,等.活性焦脱汞实验研究[J].煤质技术,2013,19(1):48-51.
ZHAO Yubing,GUO Miao,BAI Zhonghua,et al.Experimental research of mercury removal efficiency by activated coke[J].Coal Quality Technology,2013,19(1):48-51.
[11] 黄治军,段钰锋,王运军,等.改性氢氧化钙吸附脱除模拟烟气中汞的试验研究[J].中国电机工程学报,2002,9(17):56-62.
HUANG Zhijun,DUAN Yufeng,WANG Yunjun,et al.Experimental investigation on absorption of Hg in simulated fuel gas by modified Ca(OH)2[J].Proceedings of the CSEE,2009,29(17):56-62.
[12] YANG Jianping,ZHAO Yongchun,CHANG Lin,et al.Mercury adsorption and oxidation over cobalt oxide loaded magnetospheres catalyst from fly ash in oxyfuel combustion flue gas[J].Environmental Science & Technology,2015,49:8210-8218.
[13] 步学朋,徐振刚,李文华,等.活性焦性质对脱除SO2性能的影响研究[J].煤炭学报,2011,36(5):834-839.
BU Xuepeng,XU Zhengang,LI Wenhua,et al.The effects of activated coke properties on SO2 removal[J].Journal of China Coal Society,2011,36(5):834-839.
[14] DE MAHUYA,AZARGOHAR Ramin,DALAI Ajay K,et al.Mercury removal by bio-char based modified activated carbons[J].Fuel,2013,103:570-578.
[15] 王鹏.活性焦性质对脱硫脱硝的影响研究[J].煤炭技术,2016,35(9):316-318.
WANG Peng.Effect of properties on desulfurization and denitrification of activated coke[J].Coal Technology,2016,35(9):316-318.
[16] 李兵,薛建明,许月阳,等.SO2在活性炭上的吸附平衡、动力学及热力学研究[J].煤炭学报,2014,39(10):2100-2106.
LI Bing,XUE Jianming,XU Yueyang,et al.Equilibrium,kinetics and thermodynamics of SO2 adsorption on activated carbon[J].Journal of China Coal Society,2014,39(10):2100-2106.
[17] 熊银伍,杜铭华,步学鹏,等.改性活性焦脱除烟气中汞的实验研究[J].中国电机工程学报,2007,27(35):17-22.
XIONG Yinwu,DU Minghua,BU Xuepeng,et al.Experimental research of removing mercury from flue gas by modified activated coke[J].Proceedings of the CSEE,2007,27(35):17-22.
[18] 李阳,车得福,杨成龙,等.汞在活性焦脱硫工艺中的迁移规律[J].中国电机工程学报,2017,37(7):2024-2029.
LI Yang,CHE Defu,YANG Chenglong,et at.Study on mercury migration in the process of activated coke desulfuration[J].Proceedings of the CSEE,2017,37(7):2024-2029.
[19] 任建莉,周劲松,骆仲泱,等.活性炭吸附烟气中气态汞的试验研究[J].中国电机工程学报,2004,24(2):171-175.
REN Janli,ZHOU Jinsong,LUO Zhongyang,et al.An experimental study on activated carbon sorbents for gas-phase removal from flue gas[J].Proceedings of the CSEE,2004,24(2):171-175.
[20] SCALA Fabrizio,CHIRONE Riccardo,LANCIA Amedeo.Elemental mercury vapor capture by powdered activation carbon in a fluidized bed reactor[J].Fuel,2010,90:2077-2082.
[21] NING Yongcheng.Interpretation of organic spectra[M].Beijing:Science Press,2011:368-380.
[22] DING Song,LI Yuran,ZHU Tingyu,et al.Regeneration performance and carbon consumption of semi-coke and activated coke for SO2 and NO removal[J].Journal of Environmental Science,2015,34:37-43.
[23] 沈彩琴.活性炭纤维表面吸附汞机理的密度泛函理论研究[D].杭州:浙江工业大学,2015.
SHEN Caiqin.Density functional theory study on the mechanism of mercury adsorption by activated carbon fiber[D].Hangzhou:Zhejiang University of Technology,2015.
[24] MARI Teresa IZQIERDO,BEGONA Rubio,CARMEN Mayoral,et al.Low cost coal-based carbons for combined SO2 and NO removal from exhaust gas[J].Fuel,2003,82:147-151.
[25] WEI Zaishan,LUO Yuwei,LI Baoren,et al.Microwave assisted catalytic removal of elemental mercury from flue gas using Mn/zeolite catalyst[J].Atmospheric Pollution Research,2015,6(1):645-651.
[26] ZHANG Anchao,XING Weibo,ZHANG Zhihui,et al.Promotional effect of SO2 on CeO2/TiO2 material for elemental mercury removal at low temperature[J].Atmospheric Pollution Research,2016,7:895-902.
[27] GUO Yongfu,YAN Naiqiang,YANG Shijian,et al.Conversion of elemental mercury with a novel membrane catalytic system at lowtemperature[J].Journal of Hazardous Materials,2012,213-214:62-70.
[28] 张立强,崔琳,王志强,等.微波再生对活性炭循环吸附SO2的影响[J].燃料化学学报,2014,42(7):890-896.
ZHANG Liqiang,CUI Lin,WANG Zhiqiang,et al.Effects of microwave re ge ne ration of activate d carbon on its SO2 adsorption[J].Journal of Fuel Chemistry and Technology,2014,42(7):890-896.