煤炭开采筛选过程中会排放大量矸石,在风化、雨水淋滤、地表水浸泡以及微生物催化氧化作用下矸石山中金属离子和硫化物会溶出进入周边土壤和地下水形成酸性废水[1-3]。酸性废水的形成不仅对矿区周围生态环境造成严重污染,也对长期生活在矿区周围的居民造成了极大危害[4-5]。目前治理矿区煤矸石对环境造成的污染主要方法有物理法、化学法、微生物法[6-7]。利用微生物去除酸性废水中的重金属离子是当前治理污染实现矿区生态修复的研究方向之一[8]。方迪等[8]通过在小型CSTR反应器中添加硫酸盐还原菌(sulfate reducing bacteria,SRB),发现在pH=2.6~4.3条件下,SRB对重金属离子均具有较好沉淀效果。MARIA等[9]通过收集SRB菌生长过程中产生的H2S使之达到可用于处理AMD废水沉淀重金属离子的适宜浓度。也有研究者利用含有稻草和SRB的活性污泥的生物反应器处理回收酸性重金属废水中的Cu2+和Zn2+,回收率分别达到97%和87%[10]。稻壳是一种具有较好比表面积和体积的农业废弃物,具有成为载体材料的良好条件。李娟等[11]利用农业稻壳固定硫酸盐还原菌处理含镍废水,镍脱除效率达到95%。SRB通过异化作用将酸性废水中的硫酸盐还原成硫化氢,H2S进一步与废水中的金属离子发生反应并生成溶度积更小的金属硫化物沉淀。由于SRB外壳含有的羟基和羧基具有一定的缓冲作用,因此还原![]() 产生硫化氢的过程中能够使废水的pH升高从而使部分金属离子形成氢氧化物沉淀[12-13]。研究表明SRB菌体外壳含有某些基团使菌体外壳带负电荷,从而能够吸附带正电的金属离子;吸附于细胞表面的金属离子与细胞表面的某些酶结合后,可使细胞表面的金属离子转移至细胞内加以去除。而通过联合稻壳填充SRB反应器为SRB菌株生长提供厌氧及寄居环境,可知稻壳填充对SRB菌株生长能够稳定维持SRB反应器的厌氧,但稻壳对金属离子去除也存在一定程度的物理吸附作用[11]。
产生硫化氢的过程中能够使废水的pH升高从而使部分金属离子形成氢氧化物沉淀[12-13]。研究表明SRB菌体外壳含有某些基团使菌体外壳带负电荷,从而能够吸附带正电的金属离子;吸附于细胞表面的金属离子与细胞表面的某些酶结合后,可使细胞表面的金属离子转移至细胞内加以去除。而通过联合稻壳填充SRB反应器为SRB菌株生长提供厌氧及寄居环境,可知稻壳填充对SRB菌株生长能够稳定维持SRB反应器的厌氧,但稻壳对金属离子去除也存在一定程度的物理吸附作用[11]。
笔者利用SRB菌株联合稻壳的简易生物反应器处理人工合成酸性重金属废水,分析酸性废水在处理过程中理化特性(Eh,pH,Ec)及金属离子(Fe,Mn,Cr)变化规律,并利用FT-IR分析稻壳和微生物联合处理作用下重金属离子的处理特性,分析SRB处理酸性重金属废水的金属沉淀的生物作用机制,希望通过这些研究为矸石山重金属污染治理提供理论支持。
1 材料与方法
1.1 菌株和培养基
本试验采用的SRB菌株筛选自湖南湘潭某矸石山周边土壤,经分子生物学鉴定SRB菌属于Desulfuromonas alkenivoransz种,命名为Desulfuromonas alkenivorans S-7菌[14]。培养基基本组成如下:KH2PO4,0.5 g/L;NH4Cl,1.0 g/L;Na2SO4,0.5 g/L;60%乳酸钠,4.0 g/L;CaCl2·2H2O,1.0 g/L;MgSO4·7H2O,2.0 g/L;酵母提取物1.0 g/L;重金属废水中金属离子质量浓度(Fe3+ 60 mg/L,Mn2+ 25 mg/L,Cr6+ 60 mg/L),调节培养基初始pH=3.0±0.2。在接S-7菌入反应器前,需对S-7菌株重复扩培3次以上保证SRB菌数量达到要求。
1.2 重金属酸性废水的生物处理
柱式反应器装置如图1所示。该反应器内径14.0 cm,高15.0 cm,有效容积2.0 L,反应器在使用前需用3.0 mol/L HNO3浸泡72 h,并用去离子水进行漂洗。填充稻壳取自湖南某大米加工厂,将稻壳洗净、晾干,灭菌置于105 ℃干燥后填充满整个反应器,从反应器顶部充入高纯氮(99.99%),维持反应体系前期的无氧状态。试验中采用恒流蠕动泵从反应器顶部进重金属废水,通过循环水控温(30±1) ℃。
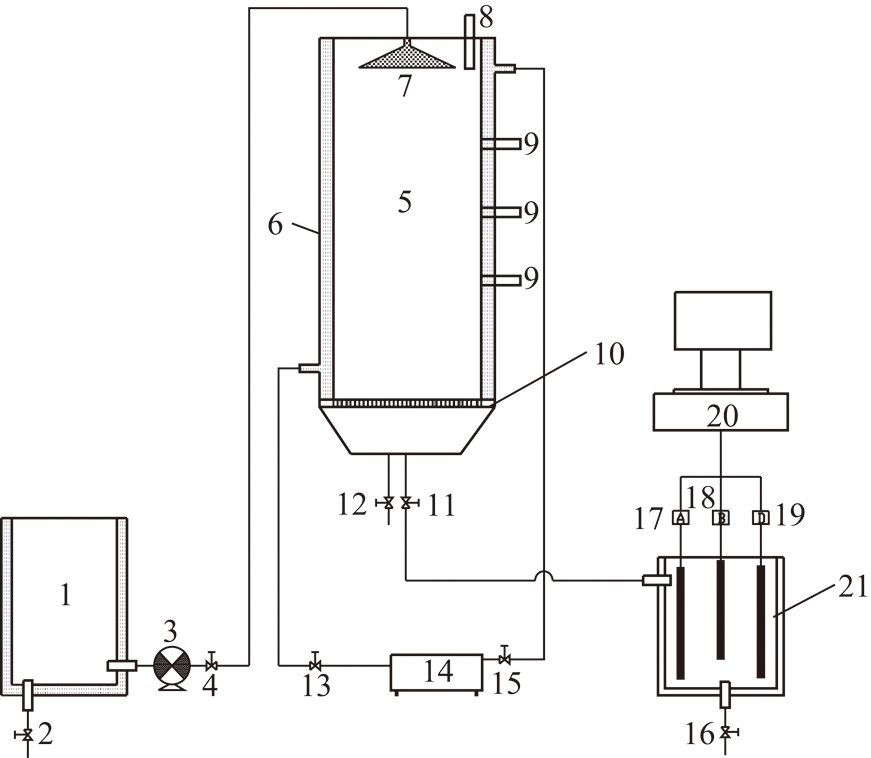
图1 柱式反应器示意
Fig.1 Schematic diagram of column reactor
1—废水储存器;2—出水阀;3—恒流泵;4—入料阀;5—反应器;6—夹套;7—喷淋头;8—微生物加样咀;9—取样咀;10—滤膜;11—入池阀;12—出水阀;13—回水阀;14—循环恒温水槽;15—回水阀;16—回收池出水阀;17—pH值检测装置;18—氧化还原点位Eh检测装置;19—电导率Ec检测装置;20—数据分析终端;21—废水回收池
本试验共设置2组试验:一组为接种SRB微生物组,另一组为空白对照组(仅填充稻壳),并设置3组平行试验。试验组添加培养至对数生长期的S-7菌,接种量为10%,空白组则只添加灭菌培养基,将填充满稻壳的两组反应器通过蠕动泵加入2 L培养液,其中试验组反应器中SRB菌培养液30 ℃恒温培养4 d。试验组及空白组反应器中分别持续添加含混合重金属(Fe3+,Mn2+,Cr6+)合成废水。合成废水需每天在无菌条件下制备,并通入高纯氮(99.99%)10 min驱除氧气,然后通过恒流泵以100 mL/d的恒定流量从反应器顶部连续泵入反应器中处理。每天从反应器底部取样口取100 mL已处理的酸性废水样以维持SRB反应器总体积不变,试验组S-7菌液则通过流加法保证细菌浓度维持在同一数量级,尽量减少细胞浓度变化的影响。
1.3 样品采集和分析
每天从试验组与对照组中取5 mL样品用于分析反应器中处理液pH、氧化还原电位(Eh)、电导率(Ec)。每天取少量样液10 000 rad/min离心分离后取上清液,用1 mol/L硝酸处理后(防止金属沉淀或者吸附于细胞表面)采用原子吸收光谱(TAS-986,北京普析通用)测定淋溶液中3种代表性金属离子(Fe,Mn和Cr)浓度。从处理20 d的SRB反应器中取部分微生物组及空白对照组稻壳样品,真空冷冻干燥8 h,研磨成粉末;并从反应器中取酸性废水处理液于4 000 rad/min离心2 min收集沉淀,取离心后的上清液于10 000 rad/min离心10 min收集细胞,将收集的沉淀、细胞经真空冷冻干燥后,采用KBr压片法制样,用傅里叶红外光谱仪(Nicolet Nexus 670,Thermo Electron,Waltham,Massachusetts)对样品进行分析,测定光谱为4 000~400 cm-1。
2 结果与讨论
2.1 S-7菌株和稻壳联合处理重金属废水理化特性分析
SRB联合稻壳处理酸性废水的pH,Eh和Ec变化曲线如图2所示。图2(a)为pH变化曲线,整体上看试验组SRB反应器培养液pH比空白组pH高。试验组酸性废水经处理前6 d其pH呈下降趋势,可能是S-7正处于生长迟缓期,随后pH整体呈上升趋势,处理8~11 d反应器中菌体进入对数生长期,pH上升较明显,这与体系发生还原反应产生了大量的溶解性硫化物例如H2S等,碱性条件下H2S起到中和作用,而酸性条件下H2S较容易从溶液中释放出来导致pH缓慢上升有关[15]。在11~14 d,菌体进入稳定期pH上升比较缓慢。在15~18 d 后pH基本维持稳定在6.20左右,18 d后略有下降趋势,这可能与S-7菌大部分处于衰退期或者SRB反应器中H2S的浓度达到一定上限,H2S超过一定浓度对SRB反应器中微生物有一定毒害作用[16]。研究表明pH值决定着游离H2S在总硫化物(HS-+H2S)中的比例,尤其当体系pH值<7.0时,游离H2S的含量较大,其对SRB有较强的抑制作用,使硫酸盐的还原速率较慢[17]。试验组尽管每天泵入SRB反应器中的酸性合成废水pH=3左右,但SRB反应器中整体pH维持上升趋势,且最终基本稳定在6.20 左右,这表明S-7处理酸性废水最大的优势在于可以提高废水的pH。而空白组SRB反应器处理的酸性废水整体呈下降趋势,主要原因是空白组SRB反应器中每天泵入酸性废水(pH=3.0左右)逐渐降低反应器中pH。图2(b)为SRB反应器处理酸性废水Eh 的变化曲线,试验组SRB反应器中Eh在处理第1~11 d 整体呈下降趋势,最高下降至-360 mV,表明试验组SRB维持比较高的还原环境,有利于S-7菌的生长,且该阶段Eh 波动比较大;试验组在处理后期(12~22 d)Eh 基本维持稳定。在试验组SRB反应器中1~11 d S-7细胞大量繁殖,由此可推测S-7菌株Eh值的波动是由细菌大量繁殖引起,越到后期(11~22 d)Eh波动越小,SRB菌株的还原能力越弱。空白组Eh整体也维持在-200 mV左右,可能原因是反应器通过联合稻壳填充及通入N2维持反应器的厌氧环境。反应器中总离子浓度变化趋势的Ec 曲线变化如图2(c)所示。试验组Ec在SRB处理1~4 d 明显升高,这与S-7菌在该阶段处于延滞期处理效果不明显基本一致。试验组在5~9 d电导率下降明显,而在11~22 d整体保持下降趋势,基本可认为SRB反应器中电导率的下降与S-7菌处理重金属废水使重金属沉淀去除有关。
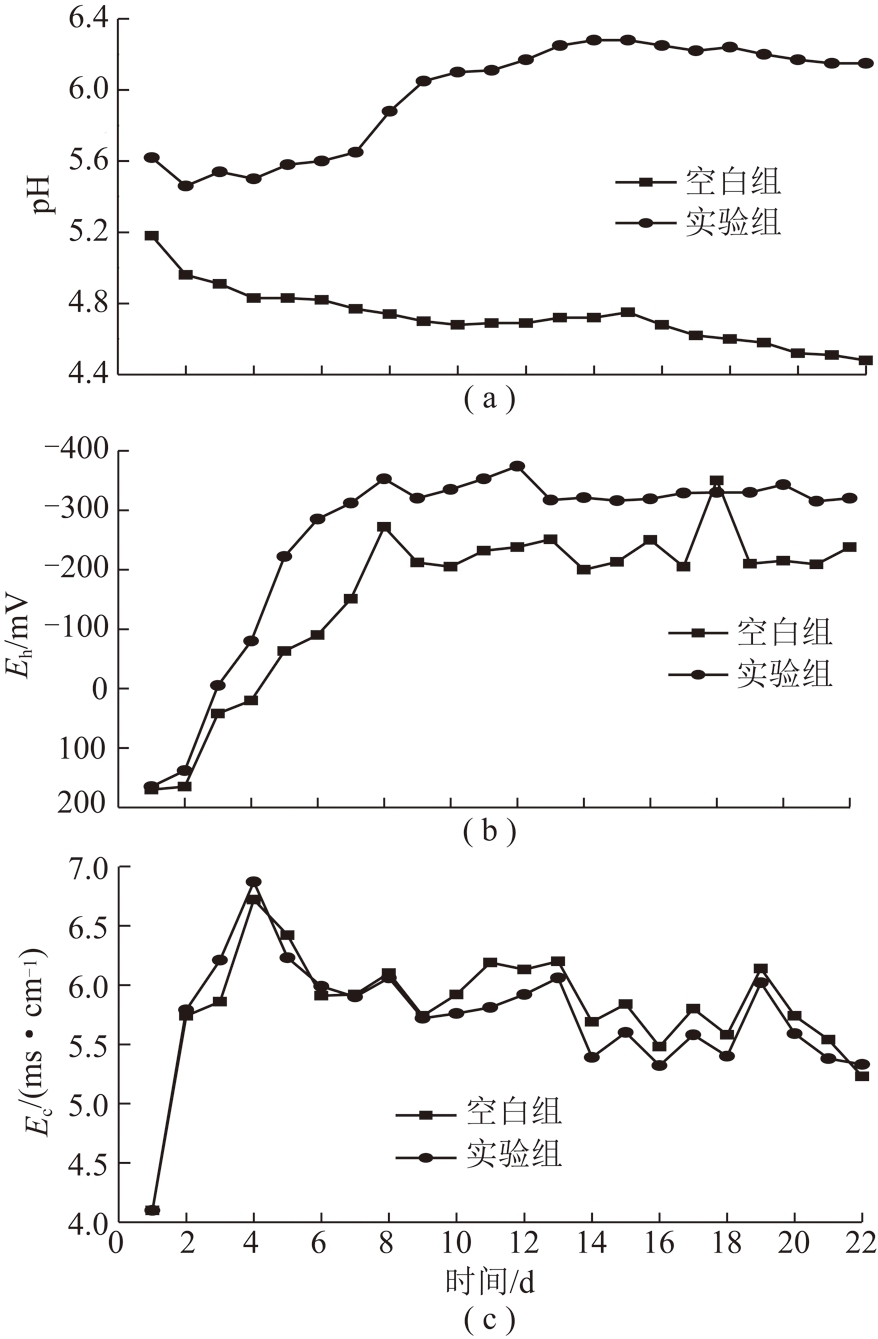
图2 微生物组和空白对照组SRB反应器中酸性废水pH,Eh和Ec变化曲线
Fig.2 Variation curves of pH,Eh and Ecin acid waste water in the SRB reactor of microbiome and sterile control group
2.2 S-7菌株和稻壳联合处理重金属废水金属离子变化
图3为反应器处理酸性废水中Fe3+,Mn2+和Cr6+质量浓度变化曲线。由图3可知,微生物组和空白组淋溶液中3种金属离子质量浓度均有变化,其中Fe3+处理效果最为明显,Mn2+次之,Cr6+变化最小。在处理前2 d,3种金属离子含量整体呈上升趋势,可知S-7菌的还原作用并不明显。试验组Fe3+质量浓度经S-7菌处理后最终质量浓度在0.72 mg/L 左右,去除效果明显(运行10 d,Fe离子去除率达95%以上);Mn2+处理质量浓度在5.20 mg/L左右(运行20 d,Mn2+去除率达79.2%),而Cr离子经处理最终质量浓度在27.00 mg/L左右(其中Cr6+在运行前5 d,去除率达95%,后期Cr6+处理并不明显)。对比试验组与空白组金属离子的变化,可知SRB反应器中填充的稻壳对金属离子有一定的吸附作用。由图3(a)可知,Fe3+在S-7菌处理前期(2~10 d),其质量浓度快速下降到0.50 mg/L左右,处理效果明显,处理后期(11~20 d)SRB反应器中Fe3+质量浓度基本维持稳定。空白组Fe3+质量浓度随进样时间的增加整体呈上升趋势。试验组Mn2+质量浓度变化趋势与Fe3+质量浓度变化趋势基本一致,去除效果最佳时期为第2~10 d。对比试验组与空白组Cr6+金属质量浓度,可基本判断S-7菌株对Cr6+去除效果并不明显。在处理第2~5 d,S-7菌株仍对Cr6+具有一定去除效果,但在处理第7~20 d SRB反应器中Cr6+质量浓度逐渐上升,基本与空白对照组中Cr6+质量浓度相近。
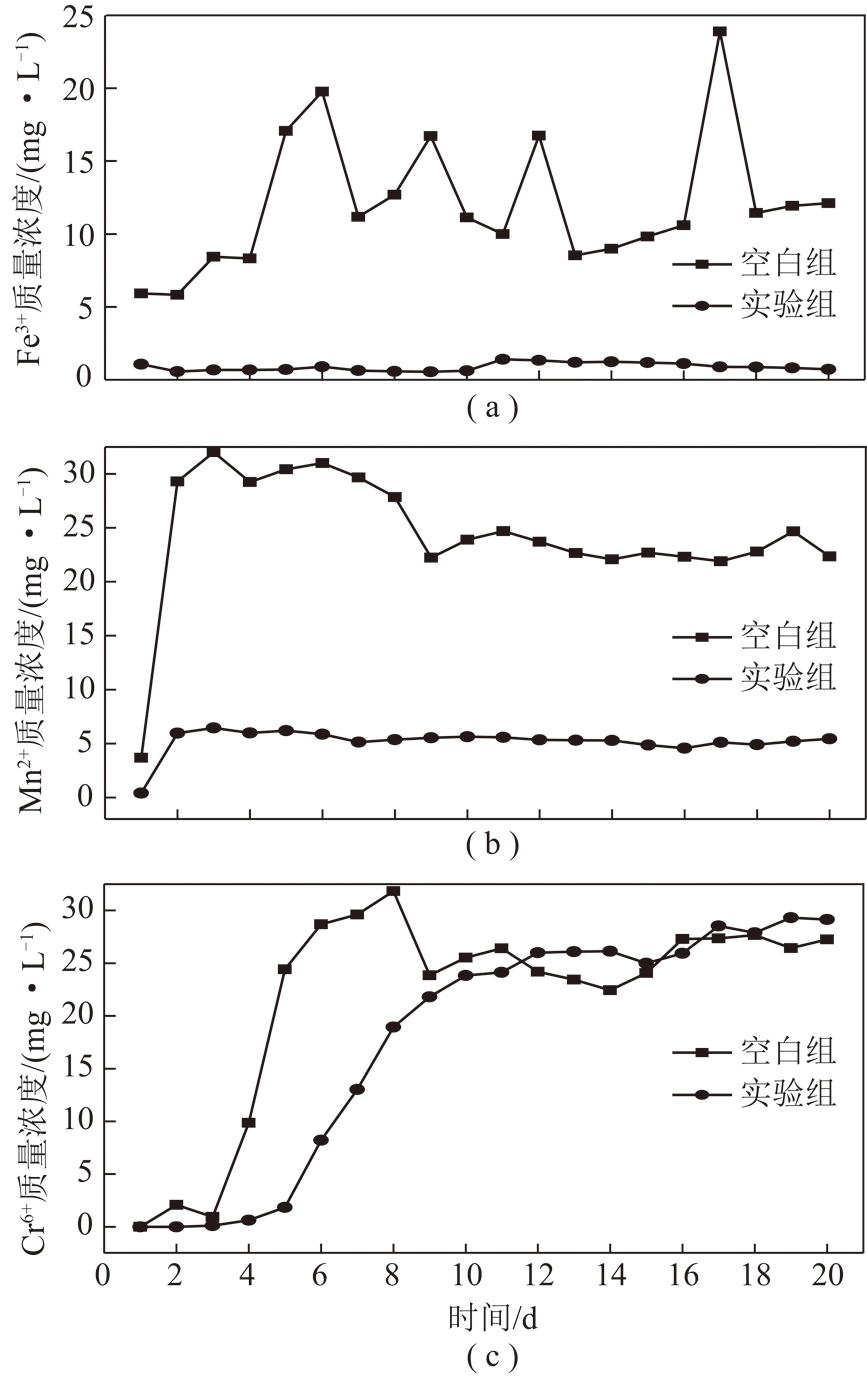
图3 微生物组和空白对照组SRB 反应器酸性废水Fe,Mn和Cr离子质量浓度变化曲线
Fig.3 Concentration variation curves of Fe,Mn and Cr in acid waste water in the column reactor of microbiome and blank control group
由图3可知,前期废水中离子的去除速率相较于后期较明显,反应器处理后期由于离子共存对废水处理的影响使废水中金属离子质量浓度趋于平衡,从而出现动态的制约平衡[18]。动态制约平衡条件下很难将金属离子完全去除,因为当反应器中累积的离子浓度分别降到制约平衡浓度下限时,就会阻碍金属离子浓度继续下降。因此本试验金属离子去除效果较好的时间为前5 d,而后期金属离子去除效果并不明显的原因可能是后期随着金属离子含量的增大,反应器中金属离子的累积浓度达到S-7菌株的致死浓度,从而减弱了菌株的还原能力。也有研究表明铜和锌的两者混合对微生物的毒性比单一重金属的毒性更加显著[19-20],因此试验中采用S-7菌株处理混合重金属废水,S-7菌株致死效应可能比较明显。由图3(c)可知,该SRB反应器对Cr6+的去除效果并不明显,可能原因在多种重金属离子存在条件下,S-7菌株处理金属的机制不一样,在Fe3+,Mn2+离子存在条件下,S-7菌株优先处理Fe3+,Mn2+离子,或者高浓度Cr6+的毒性使S-7菌株对Cr6+离子处理效果本身并不明显[21]。 SRB菌株处理含Cr6+的重金属废水时若体系中含有Fe2+离子对SRB的代谢有促进作用,可利用Fe2+和S2-生成FeS,然后利用FeS的强还原性还原Cr6+为Cr3+生成氢氧化物快速沉淀,同时生成的FeS沉淀既对微生物无毒性,又可以降低体系中硫化物的浓度从而减弱毒性[22]。也有可能反应器中的理化特性(尤其是pH),并不是处理Cr6+的最佳理化环境。同时根据目前的处理结果推测菌株S-7对3种离子的去除机制可能存在差异,有可能也存在离子共存效应,其具体原因有待进一步研究。
2.3 S-7菌株和稻壳联合处理重金属废水FT-IR光谱分析
反应器处理酸性废水实验组及空白组中稻壳、细胞FT-IR图谱如图4所示。
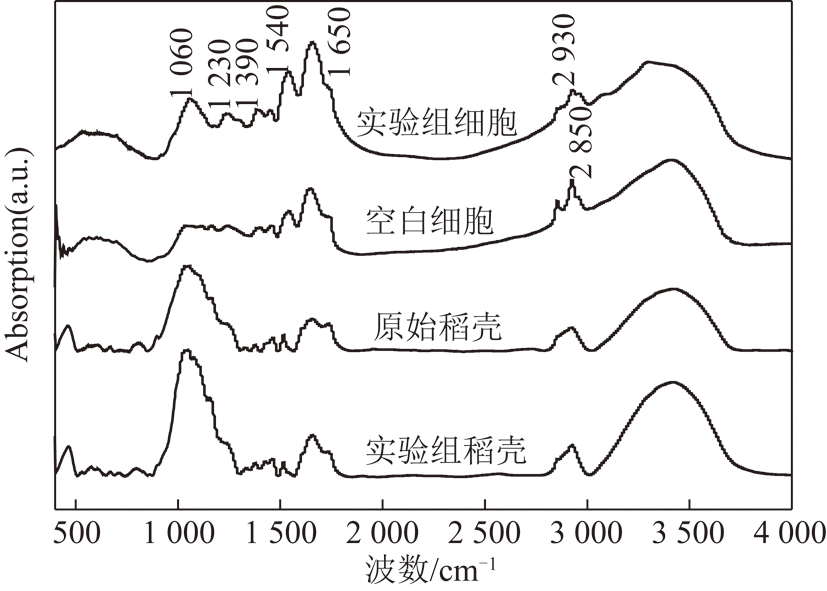
图4 实验组及空白组SRB反应器中稻壳及细胞FT-IR图谱
Fig.4 FT-IR atlas of rice husk and cell in SRB reactor of microbiome and blank control group
由图4可知,实验组及空白组稻壳两者出峰的位置并没有发生明显变化。其中实验组细胞在1 650 cm-1附近及实验组稻壳在1 058 cm-1附近的波峰吸光度均略微高于空白组,可能是由于两者之间存在不同官能团振动导致。由于稻壳及S-7细胞中许多官能团吸收带对红外图谱都有贡献,容易导致某一波数振动下发生谱峰叠加,因此很难确定吸收峰准确的出峰位置及其边界。鉴于以上情况,实验组和空白组的稻壳、细胞之间并没有明显的出峰变化,因此采用曲线拟合方法利用Peakfit软件对已测的红外光谱进行分峰拟合。根据图4 FT-IR的红外图谱,现将实验组及空白组的细胞、稻壳红外光谱在波数400~1 800,2 800~4 000 cm-1进行分峰拟合,稻壳分峰拟合图及细胞分峰拟合图分别如图5,6所示。

图5 空白细胞(a,b)和试验组细胞(c,d)在400~1 800和2 800~4 000 cm-1的FT-IR分峰结果
Fig.5 Result points peak of FT-IR on 400~1 800 and 2 800~4 000 cm-1 of blank cells(a,b) and experimental cells(c,d)

图6 空白对照组(a,b)和试验组稻壳(c,d)在400~1 800和2 800~4 000 cm-1的FT-IR分峰结果
Fig.6 Result points peak of FT-IR on 400-1 800 and 2 800-4 000 cm-1 of blank control group and experiment group rice husk
图5(a),(b)为空白细胞红外光谱,3 494 cm-1宽吸收峰是羟基和胺基伸缩振动混合吸收峰,2 850 cm-1左右的峰主要是—CH3,—CH2不对称/对称伸缩运动;1 650 cm-1处则是由C![]() O伸缩振动引起的吸收峰(酰胺Ⅰ带),1 540 cm-1处的吸收峰是—NH2的剪式振动引起(酰胺Ⅱ带),可知这两个吸收峰是蛋白质的特征吸收峰。1 455 cm-1处的吸收峰是由—CH3不对称伸缩振动引起,而1 165 cm-1处的吸收峰则可能是细胞壁主要成分——碳水化合物中C—O键的伸缩振动;1 102 cm-1附近是C—OH的伸展振动峰处理酸性重金属废水(Fe3+,Mn2+,Cr6+)后的S-7细胞红外分峰图谱如图5(c),(d)所示,对比Fe2(SO4)3,K2CrO7 标准谱图,可知铁离子的特征吸收峰在1 080 cm-1附近,
O伸缩振动引起的吸收峰(酰胺Ⅰ带),1 540 cm-1处的吸收峰是—NH2的剪式振动引起(酰胺Ⅱ带),可知这两个吸收峰是蛋白质的特征吸收峰。1 455 cm-1处的吸收峰是由—CH3不对称伸缩振动引起,而1 165 cm-1处的吸收峰则可能是细胞壁主要成分——碳水化合物中C—O键的伸缩振动;1 102 cm-1附近是C—OH的伸展振动峰处理酸性重金属废水(Fe3+,Mn2+,Cr6+)后的S-7细胞红外分峰图谱如图5(c),(d)所示,对比Fe2(SO4)3,K2CrO7 标准谱图,可知铁离子的特征吸收峰在1 080 cm-1附近,![]() 的特征吸收峰位于890 cm-1附近。由图5(c),(d)可知,在1 060 cm-1处有一个凸尖的波峰可能就是Fe3+的特征吸收峰,则可说明S-7处理废水过程中铁离子吸附于细胞表面或者进入细胞内部,而实验组细胞图谱中890 cm-1附近并没有明显的波峰,说明处理过程中铬离子并没有吸附参与到细胞内,这可能是反应器中Cr离子的处理效果不理想的原因所在。对比空白组细胞图谱,实验组分峰图谱中部分吸收峰位置有发生偏移,这可能是菌体对金属离子的吸附起作用引起吸收峰发生偏移。在3 400 cm-1附近处羟基和胺基混合振动吸收峰增强,且纯菌株—O—H的伸缩振动向低波数移动94 cm-1(3 494 cm-1到3 400 cm-1),这说明细胞在结合金属时O原子参与络合Fe,Cr,从而使振动峰红移;而1 650 cm-1处(酰胺Ⅰ带),1 540 cm-1处(酰胺Ⅱ带)蛋白质特征峰的峰强均有增强,同时羟基和羧基也有可能参与了吸附。
的特征吸收峰位于890 cm-1附近。由图5(c),(d)可知,在1 060 cm-1处有一个凸尖的波峰可能就是Fe3+的特征吸收峰,则可说明S-7处理废水过程中铁离子吸附于细胞表面或者进入细胞内部,而实验组细胞图谱中890 cm-1附近并没有明显的波峰,说明处理过程中铬离子并没有吸附参与到细胞内,这可能是反应器中Cr离子的处理效果不理想的原因所在。对比空白组细胞图谱,实验组分峰图谱中部分吸收峰位置有发生偏移,这可能是菌体对金属离子的吸附起作用引起吸收峰发生偏移。在3 400 cm-1附近处羟基和胺基混合振动吸收峰增强,且纯菌株—O—H的伸缩振动向低波数移动94 cm-1(3 494 cm-1到3 400 cm-1),这说明细胞在结合金属时O原子参与络合Fe,Cr,从而使振动峰红移;而1 650 cm-1处(酰胺Ⅰ带),1 540 cm-1处(酰胺Ⅱ带)蛋白质特征峰的峰强均有增强,同时羟基和羧基也有可能参与了吸附。
通过以上分析可以看出,S-7菌体处理重金属废水后,其表面吸附Fe,Mn,Cr离子后,羟基和胺基混合峰都增强,酰胺Ⅰ峰和酰胺Ⅱ峰都有略微的红移现象,羧基也发生了红移,说明在吸附这3种金属离子时,羟基、胺基、酰胺基及羧基是发生吸附作用重要的官能团,但S-7对3种金属离子的处理机制可能存在差异。
图6为稻壳的红外峰光谱,结合文献[23-25]相应波长处官能团的结果分析,原始稻壳在3 433 cm-1处出现的较宽吸收峰主要是由稻壳表面—OH和—NH2官能团的伸缩振动引起;2 902 cm-1处出现的峰是烷烃C—H的伸缩振动峰;1 650 cm-1处为羰基官能团的伸缩振动峰;1 520,1 460 cm-1吸收峰是芳香环烃类的不对称弯曲振动峰。由于组成稻壳的主要成分是纤维素,并且其中含硅量一般较高,所以1 000~1 100 cm-1和800 cm-1处的吸收峰主要是由Si—O—Si反对称和对称伸缩振动引起[22,24],推测1 010 cm-1处的吸收峰可能是SiO—CH3的反对称伸缩振动引起。从试验组和空白对照组稻壳的FT-IR及分峰结果可以看出,处理重金属废水前后,其红外吸收整体谱线变化不大,其吸收峰变化较明显位置主要集中在1 060 cm-1,1 650 cm-1处,说明稻壳的Si—O—Si和羰基在处理重金属废水中可能发挥了作用。
3 结 论
(1)利用S-7菌株处理酸性重金属废水,能够明显提高酸性废水的pH。试验组在SRB反应器中每天持续添加pH 3.0的酸性废水20 d,酸性废水pH 最终稳定在6.20左右。S-7菌株对3种代表性重金属离子都有一定的处理效果,去除效率为Fe > Mn >Cr。
(2)S-7菌株在吸附这3种金属离子时,羟基、胺基、酰胺基及羧基是发生吸附作用重要的官能团,但S-7对3种金属离子的处理机制可能存在差异。同时稻壳的Si—O—Si和羰基在处理重金属废水中可能也发挥了作用。稻壳填充SRB反应器不仅为S-7菌株生长提供厌氧及寄居环境,也对金属离子去除存在一定程度的物理吸附作用。
[1] LI Wei,CHEN Longqian,ZHOU Tianjian,et al.Impact of coal gangue on the level of main trace elements in the shallow groundwater of a mine reclamation area[J].Mining Science and Technology (China),2011,21(5):715-719.
[2] SILVA L F,WOLLENSCHLAGER M,OLIVEIRA M L.A preliminary study of coal mining drainage and environmental health in the Santa Catarina region Brazil[J].Environmental geochemistry and health,2011,33(1):55-65.
[3] FAN Jingsen,SUN Yuzhuang,LI Xinyu,et al.Pollution of organic compounds and heavy metals in a coal gangue dump of the gequan coal mine,china[J].Chinese Journal of Geochemistry,2013,32(3):241-247.
[4] PAPIRIO S,VILLA-GOMEZ K D,ESPOSITO G,et al.Acid mine drainage treatment in fluidized-bed bioreactors by sulfate-reducing bacteria:A critical review[J].Critical Reviews in Environmental Science and Technology,2013,43(23):2545-2580.
[5] 章非娟.工业废水污染防治[M].上海:同济大学出版社,2001:97-100.
[6] 洪芬芬.煤矸石山微生物群落和硫形态分布特征研究[D].徐州:中国矿业大学,2014.
HONG Fenfen.Study on microbial communities and distribution characteristics of sulfur speciation of coal gangue dump[D].Xuzhou:China University of Mining and Technology,2014.
[7] 廖芳芳,郑嵩,葛皓.煤矸石山生态修复方法综述[J].环保科技,2012,18(1):21-25.
LIAO Fangfang,ZHENG Song,GE Hao.Methods of ecological restoration of coal gangue hill[J].Environmental Protection Technology,2012,18(1):21-25.
[8] 方迪,王方,单红仙等.硫酸盐还原菌对酸性废水中重金属的生物沉淀作用研究[J].生态环境学报,2010,19(3):562-565.
FANG Di,WANG Fang,SHAN Hongxian,et al.Bio-precipitation of heavy metals from a synthetic acidic wastewater by sulfate-reducing bacteria in a bench scale continuous-flow stirred tank reactor[J].Journal of Ecological Environment,2010,19(3):562-565.
[9] MARIA T A,CARLA C,BO M.Precipitation of Zn(II),Cu(II) and Pb(II) at bench-scale using biogenic hydrogen sulfide from the utilization of volatile fatty acids[J].Chemosphere,2006,66:1677-1683.
[10] LU J,WU J,CHEN T,et al.Valuable metal recovery during the bioremediation of acidic mine drainage using sulfate reducing straw bioremediation system[J].Water,Air,& Soil Pollution,2012,223(6):3049-3055.
[11] 亢悦.硫酸盐还原菌在污水处理中的应用[J].广东化工,2012,39(9):120.
KANG Yue.Sulfate-reducing bacteria in sewage treatment[J].Guangdong Chemical Industry,2012,39(9):120.
[12] NECULITA C,ZAGURY G J,BUSSIÉRE B.Passive treatment of acid mine drainage in bioreactors using sulfate-reducing bacteria:Critical review and research needs[J].J.Environ.Qual.,2007,36(1):1-16.
[13] HULSHOF A H M,BLOWES D W,GOULD W D.Evaluation of in situ layers for treatment of acid mine drainage:A field comparison[J].Water Res.,2006,40(9):1816-1826.
[14] 唐婕琳,何环,张文娟,等.SRB菌的分离鉴定及其对矸石山酸性废水的处理[J].煤炭学报,2014,39(11):2307-2314.
TANG Jielin,HE Huan,ZHANG Wenjuan,et al.Isolation and identification of SRB and its utilization on processing of acid mine drainage of coal gangue dump[J].Journal of China Coal Society,2014,39(11):2307-2314.
[15] 李丛丛.废水中硫化物的生成、硫化物对生化系统的影响及其处理技术的研究[D].青岛:青岛科技大学,2014.
LI Congcong.Study on sulfide production,influence of suldide on biochemical system and removal technolygh in sulfate wastewater[D].Qingdao:Qingdao University of Science and Technology,2014.
[16] SAMIA A,TAHAR M,SAMI S.Zinc precipitation by heavy-metal tolerant sulfate-reducing bacteria enriched on phosphogypsum as a sulfate source[J].Minerals Engineering,2007,20(2):173-178.
[17] 李福德,李昕,谢翼飞,等.微生物去除重金属和砷-复合硫酸盐还原菌法的机理与技术[M].北京:化学工业出版社,2011.
[18] 王辉.混合硫酸盐还原菌生长特性及处理重金属废水的研究[D].长沙:湘潭大学,2011.
WANG Hui.Research on the growth characters of sulfate-reducing bacteria and removal of heavy metals[D].Changsha:Xiangtan University,2011.
[19] 吴大清,刁桂仪,彭金莲.阴离子表面剂与重金属离子在高岭矿物表面协同吸附效应[J].科学通报,2001(10):860-862.
WU Daqing,DIAO Guiyi,PENG Jinlian.Synergistic adsorption effect of anionic surfactant and heavy metal ions on Kaolin mineral surface[J].Science Bulletin,2001(10):860-862.
[20] HAO O J,HUANG L,CHEN J M,BUGASS R L.Effects of metal additions on sulfate reduction activity in wastewater[J].Toxicol.Environ.Chem.,1994,46(4):197-212.
[21] 李猛,张鸿郭,周子倩,等.固定化SRB处理低浓度含铬废水[J].环境工程,2016,34(4):20-24.
LI Meng,ZHANG Hongguo,ZHOU Ziqian,et al.Treatment of the wastewate containing low concentration of chromium by immobilized SRB[J].Environmental Engineering,2016,34(4):20-24.
[22] AZABOU S,MECHICH T,SAYADI S.Zinc precipitation by heavy-metal tolerant sulfate-reducing bacteria enriched on phosphogypsum as a sulfate source[J].Minerals Engineering,2007,20(2):173-178.
[23] 郑茹.生物吸附剂对地下水中铁锰的吸附特性研究[D].哈尔滨:东北农业大学,2013.
ZHENG Ru.Adsorption characteristic study of Ve(II) and Mn(II) from groundwater using biosorbents[D].Haerbin:Northeast Agricultural University,2013.
[24] 范春辉,张颖,张颖超,等.红外光谱法研究低温焚烧稻壳灰对Cr(Ⅵ)的吸附机理[J].光谱学与光谱分析,2010,30(9):2345-2349.
FAN Chunhui,ZHANG Ying,ZHANG Yingchao,et al.Cr(Ⅵ) Adsorption mechanism on rice husk ash burned at low temperature by method of IR spectra[J].Spectroscopy and Spectroscopy Analysis,2010,30(9):2345-2349.
[25] 翁诗甫.傅里叶变换红外光谱分析(第二版)[M].北京:化学工业出版社,2010.
