我国煤层气储量丰富,但储层孔裂隙发育差、渗透性低等特点,给煤层气开采带来了巨大的挑战[1-3]。为实现煤层气的高效开采,国内大量学者进行了相关研究[4-7],并提出了多种改善煤储层孔隙发育、增透技术[8-12],极大促进了我国煤层气的开发。
然而,我国煤层气抽采率仍有提高空间,急需加大相关技术研究力度。1999年,SCOTT提出微生物增产煤层气技术,并认为对煤进行微生物厌氧降解后,伴随着新的生物甲烷的合成,煤体渗透性得到显著改善[13]。国内外学者通过现场和实验室模拟实验,已证实了煤层原位微生物能够降解煤产甲烷,同时对生物成气过程形成了初步认识。认为,煤的生物厌氧降解过程,首先通过微生物的水解作用使得煤中部分官能团或共价键断裂,产生易于生物降解的简单分子,例如单环芳烃、多环芳烃、单芳羧酸、长链烷烃、长链脂肪酸以及酮和醇等[14-15];随后通过微生物的发酵作用将简单分子进一步分解为短链挥发性脂肪酸、CO2和H2等小分子化合物[16-17];最后在氢营养型产甲烷菌[18]、甲基营养型产甲烷菌[19]或乙酸发酵型产甲烷菌[20]作用下合成生物甲烷。
此外,微生物厌氧降解产甲烷还会对煤孔裂隙发育产生影响,尤其是煤中甲烷吸附和扩散最主要的场所—纳米孔隙[21]。截至目前,仅有少数学者开展了相关研究。WANG等[22]发现生物降解后,淮北烟煤的微孔孔隙率升高。PANDEY等[23-24]的研究表明,烟煤生物降解后,产生了新的孔隙,比表面积增加,气体扩散速率增强。郭红玉[25]、夏大平[26]等对长焰煤、气煤和焦煤进行生物降解实验,发现降解残煤孔裂隙增加,连通性增强,孔隙结构进一步改善。然而,也有部分学者得到相反的结果。ZHANG等[27]对次烟煤进行生物厌氧降解,发现降解残煤的中孔比表面积和孔容显著降低。PANDEY等[28-29]对生物转化后煤的变形行为进行了研究,结果表明生物降解后煤基质软化,生物甲烷的解吸使煤基质收缩,储层渗透率略微增加;但生物降解同时会引起煤体膨胀,使得储层渗透率显著降低。STEPHEN等[30]开展了烟煤型煤试件双轴加压条件下的生物降解实验,结果表明随着生物降解进行,煤渗透率不断降低。由此,生物降解对煤孔隙的影响还没有形成统一认识,而渗透率和孔隙发育降低的原因还未明晰。
已有研究表明去除煤中可溶有机小分子可改善煤孔隙结构。王飞[31]和张代钧[32]等发现,经有机溶剂萃取后,煤中部分游离态或嵌入态的有机小分子化合物被溶解,萃余煤孔容和孔隙率明显增加;JI[33]和LI[34]等研究表明,煤中可溶有机质的去除,使得部分闭孔打开,产生了新的微孔和中孔,残煤扩散特性明显增加。以上研究说明,去除煤中可溶有机质会产生明显的扩孔与疏孔作用,也即煤中可溶有机质可能会堵塞孔隙,不利于煤体孔隙发育。而生物厌氧降解会产生大量中间代谢有机产物,降解残煤孔隙降低很可能是这些厌氧代谢产物滞留于煤体中所导致的。
为更好地研究厌氧代谢产物对煤孔隙发育的影响,需要打断厌氧发酵过程的进行,尤其是甲烷生成的最后一步,使得中间产物无法被进一步代谢而在培养液和煤中积累。目前普遍采用添加产甲烷抑制剂2-溴乙烷磺酸钠(BES)来抑制生物甲烷的生成。ZHANG等[35]研究表明添加BES后,对照组中生物甲烷生成完全被抑制,且其发酵液中总有机碳含量远高于生物甲烷正常生成的实验组。OREM等[36]发现BES能有效抑制生物甲烷产生,同时还发现部分正构烷烃和长链挥发性脂肪酸在降解液中出现。已有研究说明,利用BES能够阻止甲烷生成,导致中间产物的积累。但利用添加BES来研究厌氧代谢产物在煤中滞留效应的研究鲜见报道。
已有研究多关注于长焰煤、弱黏煤、气煤以及焦煤的生物转化对煤体结构、孔隙等的影响[22,25-26],较少研究无烟煤生物转化引起的孔隙发育变化。沁水盆地作为我国煤层气开发热点区域,煤层气储量极为丰富,且是我国典型的无烟煤产区。已有研究表明,沁水盆地无烟煤可被原位菌群降解进行生物甲烷的合成[15,37]。同时,实验室前期研究发现[38],真菌在煤厌氧降解过程,尤其是煤分子断裂阶段发挥重要作用,且沁水盆地煤层气井产出水中富集驯化得到的原位真菌与产甲烷菌混合菌群能够协同进行生物甲烷的合成。
因此,笔者选用山西沁水盆地寺河矿无烟煤作为底物,以寺河矿煤层气井产出水中富集并驯化获得的原位真菌与产甲烷菌混合菌群为菌源,开展微生物厌氧降解煤产甲烷实验。采用添加产甲烷抑制剂2-溴乙烷磺酸钠溶液(BES),以促进生物降解过程中可溶性代谢有机质的积累。通过分析煤中有机质组成和孔隙参数的变化,研究生物厌氧降解中间代谢产物在煤中的滞留情况,以及对煤纳米孔隙的影响。
1 实验部分
1.1 煤样采集及理化性质分析
实验所用煤样为无烟煤,取自沁水盆地寺河矿3号煤层,煤样自井下采出后密封保存运回实验室,破碎后取60~80目(0.18~0.25 mm)颗粒,并在45 ℃下干燥6 h密封保存待后续实验使用,原煤的工业分析和元素分析分别按照国家标准GB/T 30732—2014和GB/T 31391—2015 进行,结果见表1。
表1 原煤的工业分析和元素分析结果
Table 1 Results of industrial analysis and elemental analysis in raw coal %

煤样工业分析MadAadVdafFCd元素分析CHONS原煤1.9010.418.8278.8783.013.421.761.270.31
1.2 生物产气实验
实验所用菌种由沁水盆地煤层气井产出水经过富集得到,在实验室条件下驯化培养获得的原位真菌与产甲烷菌混合菌群。在500 mL厌氧瓶中,以10 g煤为底物,加入230 mL水、30 mL基础培养液、30 mL菌液、6 mL半胱氨酸、1.5 mL微量元素和1.5 mL维生素,各营养液具体配比同文献[39]。
由于本实验主要研究原位真菌与产甲烷古菌协同作用下对无烟煤的降解,故在反应体系中加入抗生素,其由300 μL物质的量为0.1 mmol的氨苄青霉素和300 μL物质的量为0.2 mmol的链霉素组成。设置实验组和对照组两组降解实验,每组3个平行。实验组降解体系中加入2 mL,10 mmol的BES[35-36],促进厌氧降解中间产物的积累。对照组降解体系除未添加BES外,其他均与实验组相同。
所有实验在35 ℃下进行恒温培养,每隔7 d进行厌氧瓶顶空甲烷含量检测直至产气结束。分别采集实验组和对照组反应初始阶段(第0天)和反应停止阶段(第35天)的降解液,供后续液相有机物成分测定;产气结束后,收集残煤并在45 ℃下干燥至恒重,用于后续孔隙参数测定和有机溶剂萃取。
1.3 有机溶剂萃取
利用0.7 μm滤膜对降解液进行过滤,收集滤液并加入氯化钠搅拌至饱和;随后以二氯甲烷为有机溶剂,分别在酸、碱和中性条件下萃取3次,合并萃取液。
准确称取3 g原煤或降解残煤置于50 mL烧杯中,加入30 mL二氯甲烷。在室温下通过磁力搅拌器以500 r/min的速度持续搅拌萃取1 h;然后利用高速离心机以4 000 r/min的速度离心20 min,离心完成收集上层萃取液,按此过程重复萃取3次,合并萃取液。
1.4 有机物成分测定
萃取液中加入足量无水硫酸钠,低温密封静置12 h。通过旋蒸和氮吹将萃取液进一步浓缩至0.5~1.0 mL,置于棕色进样瓶中低温密封保存。
本实验中有机物测定采用美国Aglient Technologies公司生产的 7890B-5977B型气相色谱-质谱联用仪。色谱柱为HP-INNOWax(30 m×250 m×0.25 m)。测定条件为:载气为99.999%的高纯氦气,载气流速为30 mL/min;初始温度60 ℃,保持3 min,先以20 ℃/min的速度升至150 ℃,随后以5 ℃/min的速度上升到230 ℃,保持5 min。
1.5 孔隙参数测定
利用Micromeritics ASAP2020物理吸附仪对原煤、实验组和对照组残煤进行低温液氮等温吸附实验。测试前在105 ℃下抽真空处理,直至测试环境压力达到0.25 Pa。随后在77 K下测量不同相对压力下的吸附和脱附等温线。文中采用2015年国际纯粹与应用化学联合会(IUPAC)提出的纳米孔隙孔径划分[40]:微孔(<2 nm)、中孔(2~50 nm)和大孔(>50 nm)。
2 结果与讨论
2.1 产气分析
无烟煤厌氧降解产气结果如图1所示,实验组几乎没有检测到甲烷生成,说明加入产甲烷抑制剂BES显著抑制生物甲烷产生。而对照组中检测到大量甲烷产生,在0~3 d有短暂的滞后期,可能是由于在厌氧降解反应初期,可供产甲烷菌利用的小分子底物较少,导致甲烷产量增加较慢;随后进入快速增长期直到第14天,随着产甲烷菌可利用的小分子增加,甲烷产量快速增加;之后两周甲烷产量增速降低进入缓慢增长期;最终进入产气停止期,生物甲烷产量趋于稳定,每克煤最高甲烷产量为112.98 μmol。

图1 实验组和对照组产甲烷变化曲线
Fig.1 Results of methane production in experimental group and control group
2.2 孔隙结构分析
2.2.1 生物降解对煤孔隙类型的影响
利用低温氮气吸附对原煤、实验组和对照组降解残煤进行孔隙结构测试,吸附-脱附等温线如图2所示。
原煤、实验组和对照组降解残煤都在相对压力0.4~0.8内观察到很小的吸附回线。根据IUPAC对吸附回线与吸附等温线的分类结果可知[40],实验所得吸附回线类型属于H4型,且其吸附分支由Ⅰ和Ⅱ型吸附等温线复合而成,说明所测煤样中含有大量狭缝状孔隙。各样品的脱附分支在相对压力为0.5时存在较小的拐点,说明样品中存在少量墨水瓶形孔。在相对压力大于0.8时,吸脱附曲线几乎完全重合,并在相对压力接近1时快速上升,表明样品中存在部分单面开口的狭缝状平行板孔。
生物厌氧降解对煤孔隙类型没有显著影响,降解后残煤仍以狭缝状半开裂隙孔为主,并存在少量的墨水瓶形孔。SONG等[41]指出孔隙的开放程度与吸附曲线的上升速率有关。从图2中可以看出,生物降解后残煤中孔的开放程度下降且实验组残煤降低更为显著。同时,在总吸附量方面,实验组残煤减少38.1%,而对照组残煤增加10.4%。
2.2.2 生物降解对煤孔隙孔容和比表面积的影响

图2 原煤、实验组和对照组降解残煤氮气吸附脱附等温线
Fig.2 Nitrogen adsorption and desorption isotherm of raw coal, residual coal in experimental group and control group
采用DFT理论计算总孔容,BET理论计算比表面积。低温液氮孔容和比表面积测试结果见表2。生物厌氧降解后,对照组残煤总孔容与比表面积分别降低36.59%和3.43%;实验组降解残煤总孔容与比表面积降低更为显著,分别为76.42%和7.99%。
表2 低温液氮孔容和比表面积测试结果
Table 2 Results of pore volume and specific surface area by low-temperature nitrogen adsorption

样品孔容/(cm3·g-1)微孔(<2 nm)中孔(2~50 nm)总孔容比表面积/(m2·g-1)原煤0.001 30.011 00.012 333.24对照组残煤0.001 10.006 70.007 832.10实验组残煤0.000 70.002 20.002 930.58
2.2.3 生物降解对煤孔径分布的影响
利用DFT理论计算得到原煤、实验组和对照组残煤的孔径分布曲线,如图3所示。从图3看出,原煤和降解残煤主要为多峰结构,小于10 nm的孔隙占主导地位,与文献对无烟煤的孔隙检测结果一致[42-44]。生物厌氧降解后,实验组和对照组残煤的孔径分布曲线均明显低于原煤,且实验组残煤最低,与上文生物降解后总孔容与比表面积的结果趋势一致。降解残煤与原煤孔径分布趋势总体相似,但生物厌氧降解残煤的各孔径孔隙含量均明显低于原煤。结合表2可以看出,实验组和对照组残煤的微孔孔容分别降低46.15%和15.38%,而中孔降低更为显著,分别降低80.00%和39.09%。
2.2.4 生物降解对煤孔隙分形维数的影响

图3 原煤、实验组和对照组残煤的孔径分布曲线
Fig.3 Pore size distribution of raw coal,residual coal in experimental group and control group
煤的孔隙结构具有非均质性和各向异性,具有明显的分形特征。通过分形维数D可以对煤内表面的粗糙程度进行量化表征,其值通常介于2~3。分形维数D越接近3,表明煤样内表面越粗糙,孔隙结构越复杂。本文分别采用D1(<2 nm)、D2(2~10 nm)以及D3(>10 nm)来分段描述煤的分形特征。分形维数D通过Frenkel-Halsey-Hill模型(FHH)[41,45]来计算得到
其中,V为吸附体积;V0为单层吸附体积;C为常数;A为斜率;P0为饱和蒸气压;P为平衡压力;分形维数D=A+3。
原煤和降解残煤基于FHH模型的分形维数计算结果如图4所示。相关系数介于0.97~0.99,说明原煤及降解残煤纳米孔隙均具有极为明显的分形特征。图5为原煤和降解残煤各段分形维数结果。分形维数介于2.44~2.96,实验组与对照组残煤分形维数D1和D2均明显增加;添加BES后,分形维数D1和D2增加更为显著,分别增加9.93%和9.62%。而分形维数D3在降解前后变化较小,其原因可能是原煤和降解残煤均主要由<10 nm的孔隙组成(图3)。结合分形理论可知,生物厌氧降解增加了无烟煤孔隙内表面粗糙程度和孔隙结构复杂程度;添加BES后,残煤孔隙结构的粗糙程度和复杂程度进一步增加。

图4 基于FHH模型的分形维数计算结果
Fig.4 Results of fractal dimension based on FHH model

图5 原煤、实验组和对照组残煤的分形维数
Fig.5 Fractal dimension of raw coal,residual coal in experimental group and control group
2.3 有机物组成分析
2.3.1 降解液GC/MS分析
生物厌氧降解前后培养液GC/MS结果如图6所示,其中有机物峰面积与相对含量结果列于表3。实验组和对照组降解液在初始阶段的有机物组成相同,主要为酚类(相对含量分别为48.82%,53.25%)、杂环酮类(25.84%,38.85%)以及脂肪酸(25.34%,7.90%)。产气结束后,实验组和对照组的降解液中除检测到酚类化合物(14.38%,30.83%)以外,还检测到新出现的苯乙酸(11.60%,20.21%)、正十六烷酸(7.80%,25.45%)、以及少量酯类化合物(1.83%,9.34%)。在其他学者的煤降解实验中同样检测到了这些物质[16,36,46-47]。而在实验组中,还检测到短链挥发性脂肪酸,如乙酸和丁酸(相对含量分别为9.27%和5.16%);总含量为37.39%的长链脂肪烃,如二十烷(0.81%)、二十一烷(3.12%)、二十二烷(7.57%)、二十三烷(10.67%)、二十四烷(9.24%)以及三十一烷(5.98%)。已有研究表明短链挥发性脂肪酸和长链脂肪烃是与煤生物产气过程密切相关的中间代谢产物[48-49]。这说明,加入产甲烷抑制剂BES打断甲烷的生成,使得长链脂肪烃和短链挥发性脂肪酸无法被进一步降解,从而在实验组降解液中大量积累。
表3 GC/MS结果中有机物汇总
Table 3 Summary of organic detected in GC/MS

峰号化合物分子式保留时间/min实验组第0天峰面积/106相对含量/%实验组第35天峰面积/106相对含量/%对照组第0天峰面积/106相对含量/%对照组第35天峰面积/106相对含量/%1丁酸,丁基酯C8H16O25.48————————2丁基 2-甲基丁酸酯C9H18O25.60————————3丁酸,戊基酯C9H18O25.91————————4十四烷C14H306.94————————5乙酸C2H4O27.44——7.109.27————6十五烷C15H327.66————————7苯甲醛C7H6O8.06————————8十六烷C16H348.41————————92,6,10-三甲基,十六烷C19H408.94————————103-甲基,丁酸C5H10O29.150.5310.263.955.160.173.63——11十七烷C17H369.25————————122-甲基-1-十六烷醇C17H36O9.75————————132,6,10,14-四甲基,十六烷C20H429.92————————14十八烷C18H3810.22————————151-甲基萘C11H1011.20————————16十九烷C19H4011.33————————17丁基羟基甲苯C15H24O11.690.7514.692.282.980.6814.620.952.6818苯乙醇C8H10O11.79————————192-乙基,己酸C8H16O212.17————————203-羟基-2-甲基-4-吡喃酮C6H6O312.51————————21二十烷C20H4212.59——0.620.81————22苯酚C6H6O13.05————————23二十一烷C21H4413.98——2.393.12————24对甲酚C7H8O14.10————————25四氢-6-壬基,2H-吡喃-2-酮C14H26O214.83————————26二十二烷C22H4615.45——5.807.57————27芥酸C22H42O216.16————————28二十三烷C23H4816.97——8.1710.67————292,4-二叔丁基苯酚C14H22O17.411.7534.138.7311.401.8038.639.9428.1530二十四烷C24H5018.50——7.079.24————31吲哚C8H7N19.58————————322-十二碳烯酸C12H22O219.90————————33三十一烷C31H6420.03——4.585.98————345-羟甲基二氢呋喃-2-酮C5H8O320.170.8516.654.25.491.3528.883.6310.2735酞酸,丁基十四烷基酯C26H42O420.86————————36苯乙酸C8H8O221.30——8.8811.607.1420.2137二氢-4-羟基,2(3H)-呋喃酮C4H6O321.970.479.191.441.880.479.971.383.90384-甲基,戊酸C6H12O222.83————————39正十八烷酸C18H36O222.99——3.985.20——401,2-苯二羧酸,丁基辛基酯C20H30O423.17——1.401.83————41二(2-乙基己基)邻苯二甲酸酯C24H38O425.06——————3.309.34421H-吲哚-4-醇C8H7NO25.90————————43正十六烷酸C16H32O226.890.7715.085.987.800.204.278.9925.45
续 表
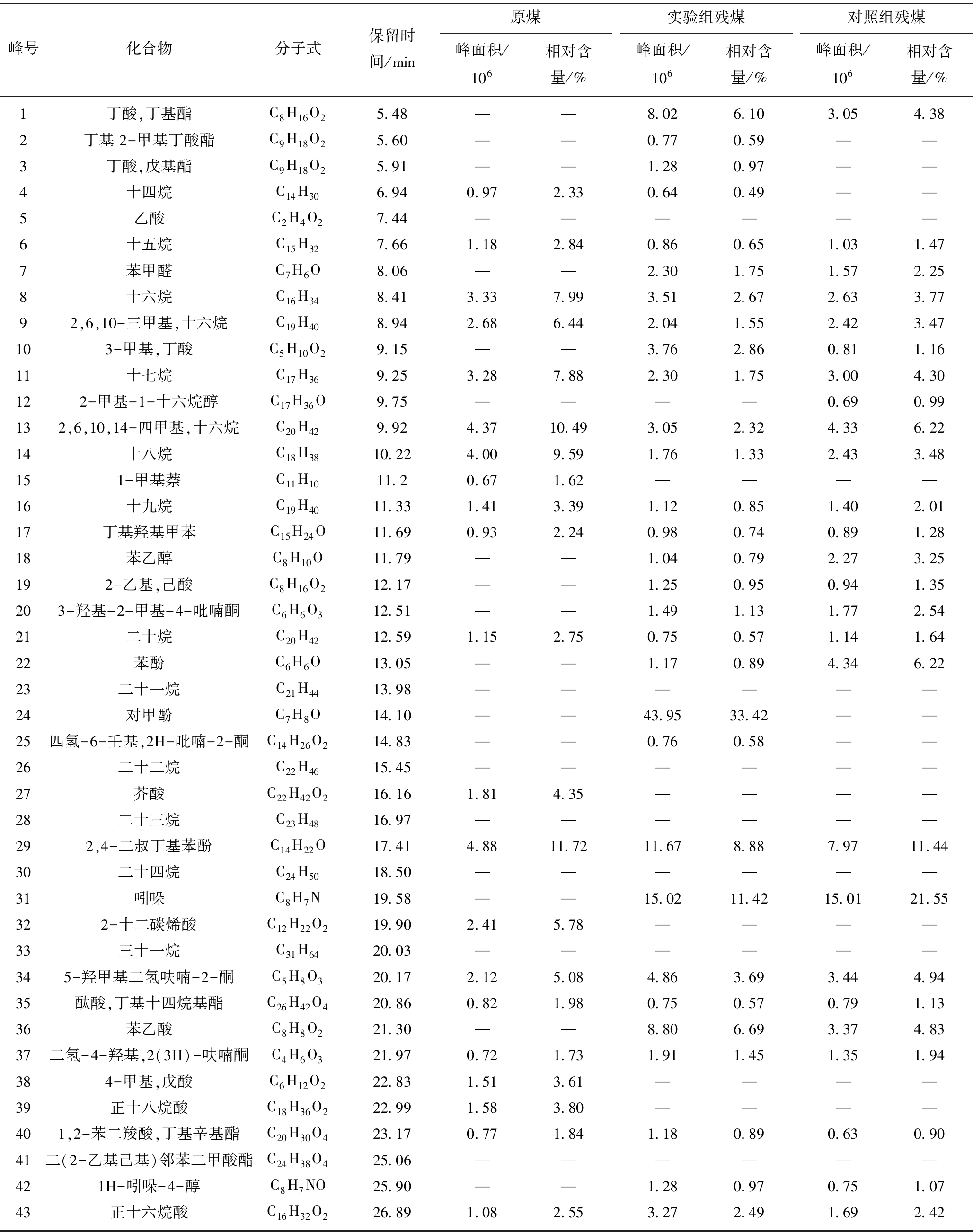
峰号化合物分子式保留时间/min原煤峰面积/106相对含量/%实验组残煤峰面积/106相对含量/%对照组残煤峰面积/106相对含量/%1丁酸,丁基酯C8H16O25.48——8.026.103.054.382丁基 2-甲基丁酸酯C9H18O25.60——0.770.59——3丁酸,戊基酯C9H18O25.91——1.280.97——4十四烷C14H306.940.972.330.640.49——5乙酸C2H4O27.44——————6十五烷C15H327.661.182.840.860.651.031.477苯甲醛C7H6O8.06——2.301.751.572.258十六烷C16H348.413.337.993.512.672.633.7792,6,10-三甲基,十六烷C19H408.942.686.442.041.552.423.47103-甲基,丁酸C5H10O29.15——3.762.860.811.1611十七烷C17H369.253.287.882.301.753.004.30122-甲基-1-十六烷醇C17H36O9.75————0.690.99132,6,10,14-四甲基,十六烷C20H429.924.3710.493.052.324.336.2214十八烷C18H3810.224.009.591.761.332.433.48151-甲基萘C11H1011.20.671.62————16十九烷C19H4011.331.413.391.120.851.402.0117丁基羟基甲苯C15H24O11.690.932.240.980.740.891.2818苯乙醇C8H10O11.79——1.040.792.273.25192-乙基,己酸C8H16O212.17——1.250.950.941.35203-羟基-2-甲基-4-吡喃酮C6H6O312.51——1.491.131.772.5421二十烷C20H4212.591.152.750.750.571.141.6422苯酚C6H6O13.05——1.170.894.346.2223二十一烷C21H4413.98——————24对甲酚C7H8O14.10——43.9533.42——25四氢-6-壬基,2H-吡喃-2-酮C14H26O214.83——0.760.58——26二十二烷C22H4615.45——————27芥酸C22H42O216.161.814.35————28二十三烷C23H4816.97——————292,4-二叔丁基苯酚C14H22O17.414.8811.7211.678.887.9711.4430二十四烷C24H5018.50——————31吲哚C8H7N19.58——15.0211.4215.0121.55322-十二碳烯酸C12H22O219.902.415.78————33三十一烷C31H6420.03——————345-羟甲基二氢呋喃-2-酮C5H8O320.172.125.084.863.693.444.9435酞酸,丁基十四烷基酯C26H42O420.860.821.980.750.570.791.1336苯乙酸C8H8O221.30——8.806.693.374.8337二氢-4-羟基,2(3H)-呋喃酮C4H6O321.970.721.731.911.451.351.94384-甲基,戊酸C6H12O222.831.513.61————39正十八烷酸C18H36O222.991.583.80————401,2-苯二羧酸,丁基辛基酯C20H30O423.170.771.841.180.890.630.9041二(2-乙基己基)邻苯二甲酸酯C24H38O425.06——————421H-吲哚-4-醇C8H7NO25.90——1.280.970.751.0743正十六烷酸C16H32O226.891.082.553.272.491.692.42

图6 反应前后培养液中萃取物的总离子流色谱
Fig.6 Total ion chromatogram of the extract in culture solution before and after biodegradation
2.3.2 原煤及降解残煤萃取物GC/MS分析
为了研究生物厌氧降解对煤中可溶有机质组成的影响,利用二氯甲烷对原煤、实验组以及对照组残煤进行了有机溶剂萃取。煤中可溶有机质组成及含量的变化如图7所示。与原煤相比,降解残煤中芳香族含氧衍生物和杂环有机物含量明显增加。芳香族含氧衍生物在实验组残煤中的含量最高为55.75%,其中43.54%为新产生;对照组残煤中含量为33.84%,其中新产生了16.55%。实验组和对照组残煤杂环有机物含量分别为18.12%和29.50%,分别新产生了14.10%和25.16%,而原煤中杂环有机物含量仅为6.81%。脂肪烃在实验组和对照组残煤中含量分别为12.19%和26.37%,远低于原煤中的53.69%。同时,脂肪族含氧衍生物含量较原煤略微降低,分别为13.94%和10.30%,但降解残煤中新产生的脂肪族含氧衍生物占比较高,含量分别为11.46%和6.89%。整体而言,实验组和对照组残煤中新产生的可溶有机质总相对含量分别为69.10%和48.59%,生物厌氧降解对煤中可溶有机质的组成产生了重要影响。

图7 原煤及降解残煤中可溶有机质含量变化
Fig.7 Content changes of soluble organic matter in raw coal and residual coal
原煤、实验组和对照组残煤萃取物的总离子流色谱图如图8所示。在原煤和降解残煤中均检测到大量C14~C19的脂肪烃,以及部分杂环酮和酚类化合物。原煤的萃取结果与季淮君[50]对无烟煤萃取结果基本相同,但文中原煤萃取物中芳香烃含量较低,仅检测到极少量的1-甲基萘,相对含量仅为1.62%,可能是萃取剂与萃取方式的不同引起的差异。从图8可知,残煤中脂肪烃种类和丰度与原煤相近,而图7中却发现,残煤脂肪烃含量明显降低。这可能是因为,生物厌氧降解后大量新产生的可溶有机质在残煤中滞留,使得残煤中可溶有机质总量显著增加,从而导致原本丰度变化较小脂肪烃,相对含量却明显降低。基于此,在后续相关性分析中并未对脂肪烃含量与孔隙参数进行相关性分析。

图8 原煤、实验组和对照组残煤的固相萃取物总离子流色谱
Fig.8 Total ion chromatogram of extract from raw coal,residual coal in experimental group and control group
与原煤相比,实验组残煤特有的新产生可溶有机质主要为对甲酚。陈林勇等[15]在寺河矿无烟煤厌氧降解过程中同样检测到丰度较高的对甲酚,且随着产气进行其丰度不断降低,这证明对甲酚是无烟煤生物降解的代谢中间产物。同时XU等[51]研究表明产甲烷抑制剂BES抑制生物甲烷产生的同时,还会使得产甲烷菌活性降低。而产甲烷菌活性降低会显著减弱对甲酚的生物降解,对甲酚的积累又会抑制乙酸生成,使得除乙酸外的其他短链挥发性脂肪酸大量积累[52],这可能是实验中发现丁酸的积累的原因(图6)。在实验组残煤和对照组残煤中均检测到新产生的苯乙酸和吲哚。在其他学者的生物厌氧降解产甲烷实验中同样检测到这两种物质的存在[36,46-47,53]。实验组和对照组产气结束后,检测到丰度较高的苯乙酸(图6),但其他新产生的可溶有机质却仅出现在降解残煤中,说明生物厌氧降解所生成的部分可溶有机质会进入到降解液中,但还有很大一部分滞留在煤体内。煤对降解后新产生的可溶有机质具有显著的滞留效应。
2.4 厌氧代谢产物对煤纳米孔隙的作用
厌氧代谢产物在煤中的滞留积累,一方面改变了煤的可溶有机质组成,同时对煤孔隙发育产生了重要影响。为进一步明确厌氧代谢产物对煤纳米孔隙的作用,对生物厌氧降解前后煤中可溶有机质含量和其对应的孔隙参数进行了相关性分析,结果如图9所示。

图9 可溶有机质含量与孔隙参数的相关性分析
Fig.9 Results of correlation analysis between the content of soluble organic matters and pore parameters in coal
原煤、实验组和对照组残煤中芳香族含氧衍生物的相对含量与煤的总孔容和比表面积呈现显著的负相关关系,相关系数均为0.99;而与煤的分形维数D1和D2呈极强的正相关关系,相关系数分别为0.94和0.98。杂环有机物与煤的总孔容、比表面积、以及分形维数D1和D2均呈相对较弱的相关关系,相关系数在0.54~0.85。同时也发现,煤中芳香族含氧衍生物与杂环有机物含量均与分形维数D3呈较弱的相关性,相关系数分别为0.67和0.13。因此,微生物代谢产生的可溶有机质,尤其是芳香族含氧衍生物在煤中的滞留积累是微生物厌氧降解影响煤孔隙发育的主要途径。
综上,厌氧降解过程中产生的有机物,尤其是芳香族含氧衍生物在降解残煤中的滞留,导致残煤孔隙表面粗糙程度和孔隙结构复杂程度增加。一方面,表面粗糙程度的增加会提供更多吸附位点,增加气体吸附量;而另一方面,孔隙结构复杂程度的增加会使得孔隙表面毛细凝聚效应更为显著,气/液面张力变大,降低气体吸附量[54]。当相对压力小于0.3时(图2),煤中气体吸附主要以微孔填充和单层吸附为主,降解残煤中更粗糙的孔隙表面,使得添加BES降解后残煤的吸附量最高,而原煤吸附量最低。而当相对压力大于0.3时,伴随多层吸附完成,毛细凝聚效应开始出现,降解残煤中更复杂的孔隙结构,导致降解残煤的吸附量降低,由此出现添加BES降解残煤吸附量最低而原煤吸附量最高的现象。
3 结 论
(1)生物厌氧降解后,残煤总孔容与比表面积明显降低,同时分形维数D1(<2 nm)和D2(2~10 nm)明显增加,残煤孔隙表面粗糙程度和复杂程度增加。添加BES增强了微生物厌氧降解对煤孔隙的作用。
(2)与原煤相比,残煤中芳香族含氧衍生物和杂环有机物含量增加,而脂肪烃含量降低。新产生的可溶有机质在实验组和对照组残煤中的相对含量分别高达69.10%和48.59%,主要为芳香族含氧衍生物、杂环有机物以及少量的脂肪族含氧衍生物。其中,实验组残煤可溶有机质主要为对甲酚(33.42%),而对照组主要为吲哚(21.55%)。同时,除苯乙酸外其它新产生的可溶有机质均未在降解液中检出,说明煤对降解后新产生的可溶有机质具有显著的滞留效应。
(3)芳香族含氧衍生物含量与总孔容和比表面积呈极强负相关关系,与分形维数D1和D2呈显著正相关关系,而杂环有机物含量与煤孔隙参数的相关性较弱。
(4)厌氧代谢产物在微生物降解对煤孔隙影响中发挥重要作用;微生物代谢产生的可溶有机质,尤其是芳香族含氧衍生物在煤中的滞留积累是微生物厌氧降解影响煤孔隙发育的主要途径。
[1] 曹代勇,聂敬,王安民,等.鄂尔多斯盆地东缘临兴地区煤系气富集的构造-热作用控制[J].煤炭学报,2018,43(6):1526-1532.
CAO Daiyong,NIE Jing,WANG Anmin,et al.Structural and thermal control of enrichment conditions of coal measure gases in Linxing block of eastern Ordos Basin[J].Journal of China Coal Society,2018,43(6):1526-1532.
[2] 申建,秦勇,张兵,等.鄂尔多斯盆地东缘临兴区块煤系叠置含气系统及其兼容性[J].煤炭学报,2018,43(6):1614-1619.
SHEN Jian,QIN Yong,ZHANG Bing,et al.Superimposing gas-bearing system in coal measures and its compatibility in Linxing block,east Ordos Basin[J].Journal of China Coal Society,2018,43(6):1614-1619.
[3] 姚艳斌,刘大锰.基于核磁共振弛豫谱技术的页岩储层物性与流体特征研究[J].煤炭学报,2018,43(1):181-189.
YAO Yanbin,LIU Dameng.Petrophysical properties and fluids transportation in gas shale:A NMR relaxation spectrum analysis method[J].Journal of China Coal Society,2018,43(1):181-189.
[4] 刘见中,孙海涛,雷毅,等.煤矿区煤层气开发利用新技术现状及发展趋势[J].煤炭学报,2020,45(1):258-267.
LIU Jianzhong,SUN Haitao,LEI Yi,et al.Current situation and development trend of coalbed methane development and utilization technology in coal mine area[J].Journal of China Coal Society,2020,45(1):258-267.
[5] 孟尚志,李勇,王建中,等.煤系“三气”单井筒合采可行性分析——基于现场试验井的讨论[J].煤炭学报,2018,43(1):168-174.
MENG Shangzhi,LI Yong,WANG Jianzhong,et al.Co-production feasibility of “Three gases” in coal measures:Discussion based on field test well[J].Journal of China Coal Society,2018,43(1):168-174.
[6] 秦勇,吴建光,申建,等.煤系气合采地质技术前缘性探索[J].煤炭学报,2018,43(6):1504-1516.
QIN Yong,WU Jianguang,SHEN Jian,et al.Frontier research of geological technology for coal measure gas joint-mining[J].Journal of China Coal Society,2018,43(6):1504-1516.
[7] 秦勇,吴建光,张争光,等.基于排采初期生产特征的煤层气合采地质条件分析[J].煤炭学报,2020,45(1):241-257.
QIN Yong,WU Jianguang,ZHANG Zhengguang,et al.Analysis of geological conditions for coalbed methane co-production based on production characteristics in early stage of drainage[J].Journal of China Coal Society,2020,45(1):241-257.
[8] 卢义玉,廖引,汤积仁,等.页岩超临界CO2压裂起裂压力与裂缝形态试验研究[J].煤炭学报,2018,43(1):175-180.
LU Yiyu,LIAO Yin,TANG Jiren,et al.Experimental study on fracture initiation pressure and morphology in shale using supercritical CO2 fracturing[J].Journal of China Coal Society,2018,43(1):175-180.
[9] 孟召平,雷钧焕,王宇恒.基于Griffith强度理论的煤储层水力压裂有利区评价[J].煤炭学报,2020,45(1):268-275.
MENG Zhaoping,LEI Junhuan,WANG Yuheng.Evaluation of favorable areas for hydraulic fracturing of coal reservoir based on Griffith strength theory[ J].Journal of China Coal Society,2020,45(1):268-275.
[10] 许耀波,郭盛强.软硬煤复合的煤层气水平井分段压裂技术及应用[J].煤炭学报,2019,44(4):1169-1177.
XU Yaobo,GUO Shengqiang.Technology and application of staged fracturing in coalbed methane horizontal well of soft and hard coal composite coal seam[ J].Journal of China Coal Society,2019,44(4):1169-1177.
[11] 张群,葛春贵,李伟,等.碎软低渗煤层顶板水平井分段压裂煤层气高效抽采模式[J].煤炭学报,2018,43(1):150-159.
ZHANG Qun,GE Chungui,LI Wei,et al.A new model and application of coalbed methane high efficiency production from broken soft and low permeable coal seam by roof strata-in horizontal well and staged hydraulic fracture[J].Journal of China Coal Society,2018,43(1):150-159.
[12] 张东明,白鑫,尹光志,等.低渗煤层液态CO2相变定向射孔致裂增透技术及应用[J].煤炭学报,2018,43(7):1938-1950.
ZHANG Dongming,BAI Xin,YIN Guangzhi,et al.Research and application on technology of increased permeability by liquid CO2 phase change directional jet fracturing in low-permeability coal seam[J].Journal of China Coal Society,2018,43(7):1938-1950.
[13] SCOTT Andrew R.Improving coal gas recovery with microbially enhanced coalbed methane[A].Coalbed methane:Scientific,environmental and economic evaluation[C].Springer,1999:89-110.
[14] PARK Stephen Y,LIANG Yanna.Biogenic methane production from coal:A review on recent research and development on microbially enhanced coalbed methane(MECBM)[J].Fuel,2016,166:258-267.
[15] 陈林勇,王保玉,邰超,等.无烟煤微生物成气中间代谢产物组成及其转化[J].煤炭学报,2016,41(9):2305-2311.
CHEN Linyong,WANG Baoyu,TAI Chao,et al.Composition and conversion of intermediate products in the process of anthracite gasification by microorganism[J].Journal of China Coal Society,2016,41(9):2305-2311.
[16] JONES Elizabeth Jp,VOYTEK Mary A,CORUM Margo D,et al.Stimulation of methane generation from nonproductive coal by addition of nutrients or a microbial consortium[J].Appl Environ Microbiol,2010,76(21):7013-7022.
[17] ![]() Dariusz,PICARDAL Flynn W,TURICH Courtney,et al.Methane-producing microbial community in a coal bed of the Illinois Basin[J].Appl Environ Microbiol,2008,74(8):2424-2432.
Dariusz,PICARDAL Flynn W,TURICH Courtney,et al.Methane-producing microbial community in a coal bed of the Illinois Basin[J].Appl Environ Microbiol,2008,74(8):2424-2432.
[18] PAPENDICK Samuel L,DOWNS Kajda R,VO Khang D,et al.Biogenic methane potential for Surat Basin,Queensland coal seams[J].International Journal of Coal Geology,2011,88(2-3):123-134.
[19] GUO Hongguang,LIU Ruyin,YU Zhisheng,et al.Pyrosequencing reveals the dominance of methylotrophic methanogenesis in a coal bed methane reservoir associated with Eastern Ordos Basin in China[J].International Journal of Coal Geology,2012,93:56-61.
[20] BECKMANN Sabrina,LUEDERS Tillmann,KRÜGER Martin,et al.Acetogens and acetoclastic methanosarcinales govern methane formation in abandoned coal mines[J].Appl Environ Microbiol,2011,77(11):3749-3756.
[21] SONG Yu,JIANG Bo,LIU Jiegang.Nanopore structural characteristics and their impact on methane adsorption and diffusion in low to medium tectonically deformed coals:Case study in the Huaibei coal field[J].Energy & Fuels,2017,31(7):6711-6723.
[22] WANG Bobo,YU Zhisheng,ZHANG Yiming,et al.Microbial communities from the Huaibei Coalfield alter the physicochemical properties of coal in methanogenic bioconversion[J].International Journal of Coal Geology,2019,202:85-94.
[23] PANDEY Rohit,HARPALANI Satya.An imaging and fractal approach towards understanding reservoir scale changes in coal due to bioconversion[J].Fuel,2018,230:282-297.
[24] PANDEY Rohit,HARPALANI Satya,FENG Ruimin,et al.Changes in gas storage and transport properties of coal as a result of enhanced microbial methane generation[J].Fuel,2016,179:114-123.
[25] 郭红玉,罗源,马俊强,等.不同煤阶煤的微生物增透效果和机理分析[J].煤炭学报,2014,39(9):1886-1891.
GUO Hongyu,LUO Yuan,MA Junqiang,et al.Analysis of mechanism and permeability enhancing effect via microbial treatment on different rank coals[J].Journal of China Coal Society,2014,39(9):1886-1891.
[26] 夏大平,苏现波,吴昱,等.不同预处理方式和模拟产气实验对煤结构的影响[J].煤炭学报,2013,38(1):129-133.
XIA Daping,SU Xianbo,WU Yu,et al.Effect of experiment of different pretreatment methods and simulating biogenic methane production on coal structure[J].Journal of China Coal Society,2013,38(1):129-133.
[27] ZHANG Rui,LIU Shimin,BAHADUR Jitendra,et al.Changes in pore structure of coal caused by coal-to-gas bioconversion[J].Sci Rep,2017,7(1):3840.
[28] PANDEY Rohit,HARPALANI Satya.Impact of bioconversion on matrix strain response of coal reservoirs:Part 1-Experimental insights[J].Fuel,2019,239:1363-1375.
[29] PANDEY Rohit,HARPALANI Satya.Impact of bioconversion on matrix strain response of coal reservoirs:Part 2-Reservoir insights[J].Fuel,2019,239:1376-1387.
[30] STEPHEN Anil,ADEBUSUYI Abigail,BALDYGIN Aleksey,et al.Bioconversion of coal:New insights from a core flooding study[J].Rsc Advances,2014,4(43):22779-22791.
[31] 王飞,张代钧,李小鹏,等.煤及其溶剂萃取产物的氮气吸附行为[J].燃料化学学报,2003,31(5):395-399.
WANG Fei,ZHANG Daijun,LI Xiaopeng,et al.Adsorption behaviors for nitrogen by coal,its extract fractions and residues[J].Journal of Fuel Chemistry and Technology,2003,31(5):395-399.
[32] 张代钧,王飞,李小鹏,等.溶剂萃取对烟煤孔隙结构和粒度的影响[J].燃料化学学报,2004,32(1):18-22.
ZHANG Daijun,WANG Fei,LI Xiaopeng,et al.Effect of solvent extraction on pore character and granularity of bituminous coal[J].Journal of Fuel Chemistry and Technology,2004,32(1):18-22.
[33] JI Huaijun,LI Zenghua,YANG Yongliang,et al.Effects of organic micromolecules in coal on its pore structure and gas diffusion characteristics[J].Transport in Porous Media,2015,107(2):419-433.
[34] LI Pengpeng,ZHANG Xiaodong,ZHANG Shuo.Structures and fractal characteristics of pores in low volatile bituminous deformed coals by low-temperature N2 adsorption after different solvents treatments[J].Fuel,2018,224:661-675.
[35] ZHANG J,YIP C,XIA C,et al.Evaluation of methane release from coals from the San Juan basin and Powder River basin[J].Fuel,2019,244:388-394.
[36] OREM William H,VOYTEK Mary A,JONES Elizabeth J,et al.Organic intermediates in the anaerobic biodegradation of coal to methane under laboratory conditions[J].Organic Geochemistry,2010,41(9):997-1000.
[37] 杨秀清,陈彦梅,魏国琴,等.寺河矿煤地质产甲烷微生物菌群的保藏和产甲烷性能[J].微生物学通报,2018,45(5):951-961.
YANG Xiuqing,CHEN Yanmei,WEI Guoqin,et al.Preservation and methane production of methanogenic microbial consortia from coal geological environment in Sihe Mine[J].Microbiology China,2018,45(5):951-961.
[38] GUO Hongguang,ZHANG Jinlong,HAN Qing,et al.Important role of fungi in the production of secondary biogenic coalbed methane in China’s southern Qinshui basin[J].Energy & Fuels,2017,31(7):7197-7207.
[39] GUO Hongguang,CHENG Yatong,HUANG Zaixing,et al.Factors affecting co-degradation of coal and straw to enhance biogenic coalbed methane[J].Fuel,2019,244:240-246.
[40] THOMMES Matthias,KANEKO Katsumi,NEIMARK Alexander V,et al.Physisorption of gases,with special reference to the evaluation of surface area and pore size distribution(IUPAC Technical Report)[J].Pure and Applied Chemistry,2015,87(9-10):1051-1069.
[41] YU Song,BO Jiang,LI Fengli,et al.Structure and fractal characteristic of micro-and meso-pores in low,middle-rank tectonic deformed coals by CO2 and N2 adsorption[J].Microporous and Mesoporous Materials,2017,253:191-202.
[42] GAO Di,LI Meng,WANG Baoyu,et al.Characteristics of pore structure and fractal dimension of isometamorphic anthracite[J].Energies,2017,10(11):1881.
[43] NIE Baisheng,LIU Xianfeng,YANG Longlong,et al.Pore structure characterization of different rank coals using gas adsorption and scanning electron microscopy[J].Fuel,2015,158:908-917.
[44] 郝世雄,王承洋,江成发.固定碳对煤的孔结构和甲烷吸附量的影响[J].煤炭学报,2012,37(9):1477-1482.
HAO Shixiong,WANG Chengyang,JIANG Chengfa.Influence of fixed carbon on coal textural character and methane adsorption capacity[J].Journal of China Coal Society,2012,37(9):1477-1482.
[45] LIU Shiqi,MA Jingsheng,SANG Shuxun,et al.The effects of supercritical CO2 on mesopore and macropore structure in bituminous and anthracite coal[J].Fuel,2018,223:32-43.
[46] OREM William H,TATU Calin A,LERCH Harry E,et al.Organic compounds in produced waters from coalbed natural gas wells in the Powder River Basin,Wyoming,USA[J].Applied Geochemistry,2007,22(10):2240-2256.
[47] ![]() Dariusz,MASTALERZ Maria,DAWSON Katherine,et al.Biogeochemistry of microbial coal-bed methane[J].Annual Review of Earth and Planetary Sciences,2011,39:617-656.
Dariusz,MASTALERZ Maria,DAWSON Katherine,et al.Biogeochemistry of microbial coal-bed methane[J].Annual Review of Earth and Planetary Sciences,2011,39:617-656.
[48] JONES Elizabeth JP,HARRIS Steve H,BARNHART Elliott P,et al.The effect of coal bed dewatering and partial oxidation on biogenic methane potential[J].International Journal of Coal Geology,2013,115:54-63.
[49] WAWRIK Boris,MENDIVELSO Margarita,PARISI Victoria A,et al.Field and laboratory studies on the bioconversion of coal to methane in the San Juan Basin[J].FEMS Microbiology Ecology,2012,81(1):26-42.
[50] 季淮君.可溶有机质对煤层瓦斯储运特性影响机理研究[D].徐州:中国矿业大学,2015.
JI Huaijun.Mechanism of soluble organic matter influencing on coal gas storage and transport properties[D].Xuzhou:China University of Mining and Technology,2015.
[51] XU Kewei,LIU He,LI Xiufen,et al.Typical methanogenic inhibitors can considerably alter bacterial populations and affect the interaction between fatty acid degraders and homoacetogens[J].Applied Microbiology and Biotechnology,2010,87(6):2267-2279.
[52] RÉTFALVI Tamás,TUKACS-H JOS Annamária,SZAB
JOS Annamária,SZAB Piroska.Effects of artificial overdosing of p-cresol and phenylacetic acid on the anaerobic fermentation of sugar beet pulp[J].International Biodeterioration & Biodegradation,2013,83:112-118.
Piroska.Effects of artificial overdosing of p-cresol and phenylacetic acid on the anaerobic fermentation of sugar beet pulp[J].International Biodeterioration & Biodegradation,2013,83:112-118.
[53] HAIDER Rizwan,GHAURI Muhammad A,SANFILIPO John R,et al.Fungal degradation of coal as a pretreatment for methane production[J].Fuel,2013,104:717-725.
[54] YAO Yanbin,LIU Dameng,TANG Dazhen,et al.Fractal characterization of adsorption-pores of coals from North China:An investigation on CH4 adsorption capacity of coals[J].International Journal of Coal Geology,2008,73(1):27-42.
