(1.煤炭科学技术研究院有限公司 北京煤化工研究分院,北京 100013; 2.煤炭科学技术研究院有限公司 煤炭资源开采与洁净利用国家重点实验室,北京 100013; 3.煤炭科学技术研究院有限公司 国家能源煤炭高效利用与节能减排技术装备重点实验室,北京 100013)
2,6-萘二甲酸(2,6-NDA)是高端聚酯聚萘二甲酸乙二醇酯(PEN)的重要单体。由于2,6-NDA的高度对称结构性,使得PEN聚酯与目前常用的以对苯二甲酸为单体获得的聚对苯二甲酸乙二醇酯(PET)相比,在耐热性、阻气性能和化学稳定性等方面性能优越[1-4],2,6-NDA的合成引起了学术界和工业界的高度重视[5-8]。尽管PEN聚酯材料性能卓越,但现有制备2,6-NDA的工艺复杂、投资大,制约了PEN的发展及市场应用。
目前,国外工业化生产2,6-萘二甲酸主要采用化学合成法,即以价格高的纯物质(邻二甲苯与1,3-丁二烯)经侧链烷基化、环化、脱氢、异构化、纯化等获得2,6-二甲基萘(2,6-DMN),再液相氧化、酯化得到2,6-萘二甲酸或2,6-萘二甲酸二甲酯,该生产工艺路线长,分离过程复杂,投资大[9]。日本三菱瓦斯化学公司开发的工艺是以β-甲基萘为原料、HF/BF3为催化剂、乙酰氟为酰化剂,经酰基化获得2-甲基-6-乙酰基萘(纯度>98%),但由于反应中使用毒性大的HF/BF3为催化剂,出现生产设备腐蚀等问题[10-12]导致其生产和设备维护成本高昂。目前国内2,6-萘二甲酸的生产处于实验室研究阶段,还未步入中试生产和工业装置应用阶段。由于2,6-二甲基萘易氧化生成2,6-萘二甲酸[13],早期研究者主要集中在2,6-二甲基萘的直接分离提取和β-甲基萘的烷基化反应获得2,6-二甲基萘上[14-16]。舒歌平、李文博等[17-19]利用间硝基苯甲酸法、乳化液膜结晶法从煤焦油洗油中分离提纯2,6-二甲基萘,但由于2,6-二甲基萘有10种同分异构体,其中2,6-DMN与2,7-DMN沸点仅差0.3 ℃,2,6-DMN分离提纯难度大严重限制了该方法的工业化应用。与烷基化相比,以β-甲基萘为原料的酰基化工艺具有副产物少、产品收率高、反应更彻底的优点[20-21],是一种具备工业化前景的合成方案。鉴于我国煤基衍生油资源丰富的现状,以煤焦油洗油馏分中的β-甲基萘为原料[22],采用酰化反应来制备2-甲基-6-酰基萘再氧化获得2,6-NDA,既合理利用了萘系副产化合物,又得到了具有大量市场需求的2,6-NDA。
笔者以β-甲基萘为原料,通过酰化合成反应、分离纯化获得酰化纯品,采用色谱、质谱、1H-HMN、13C-NMR及二维核磁联合确定了酰化纯品的分子结构为2-甲基-6-丙酰基萘,并对酰化合成反应过程机理进行探讨。
1 实验部分
1.1 原料及试剂的选择
试验所用到的化学试剂β-甲基萘、AlCl3催化剂、丙酰氯、硝基苯等均购自国药。
1.1.1 催化剂的选择
AlCl3催化剂为工业上常用的酰基化反应催化剂。相对于其他的Lewis催化剂,如FeCl3,ZnCl2等,AlCl3催化反应活性最高,且在后期酰化产物水洗处理时耗水量相对较少,所以选择AlCl3为试验催化剂。
1.1.2 酰化剂的选择
常用的酰氯酰化剂有乙酰氯、丙酰氯和丁酰氯,考虑到丙酰氯相对于乙酰氯具有更大的分子尺寸,酰化合成空间位阻效应更有利于其对位的选择性。丁酰氯比丙酰氯沸点更高,分子尺寸更大,从原子的经济性和分子尺寸效应综合考虑,选择丙酰氯为酰化剂。
1.1.3 溶剂的选择
因AlCl3催化剂在硝基苯溶液中的溶解度大,硝基苯更有利于2-甲基萘生成6-配位的酰基化产物,选择硝基苯为溶剂。
1.2 酰化合成反应及提纯实验
选用β-甲基萘和丙酰氯为原料,AlCl3为催化剂,硝基苯为溶剂,在三口烧瓶中进行酰化合成反应,控制物料物质的量比为β-甲基萘∶丙酰氯∶三氯化铝=1.0∶1.4∶1.7。具体操作为:① 酰化液的制备:在三口烧瓶中,加入150 g硝基苯、31.88 g无水氯化铝,待恒温槽温度降至-5 ℃后缓慢加入18.22 g丙酰氯,控制溶液温度在 0 ℃以下,继续搅拌60 min使之充分混合;② 在另一个三口烧瓶中,加入100 g硝基苯和20 g β-甲基萘,待恒温槽温度降至-5 ℃后,将步骤①中配制的酰化液由恒压滴液漏斗向烧瓶中缓慢滴加,控制滴加速度,控制溶液温度在 0 ℃以下。滴加完毕后继续搅拌60 min使之充分混合,然后控制反应温度25 ℃反应时长5 h;③ 酰化反应结束后,对酰化产物水解、水解产物进行减压蒸馏蒸除夹带水及溶剂,获得酰化产物粗品;④ 采用甲醇水溶液(甲醇含水量15%)重结晶提纯酰化产物粗品,获得酰化产物纯品。重点对酰化产物纯品进行表征分析。
1.3 酰化产物的表征分析
采用Agilent 7890A气相色谱,Nicolet Nexus 410型傅里叶变换红外成像光谱仪(FT-IR)、岛津GCMS QP2010、Bruker Avance III HD 500MHz/600MHz型核磁共振波谱仪等获取酰化产物的结构信息。
具体测试条件步骤:
(1)气相色谱测试条件。硝基苯为溶剂,氦气为载气,色谱柱采用DB-Petro 100 m×250 μm×0.25 μm毛细管柱,进样温度320 ℃,柱流量0.8 mL/min,柱炉升温程序为:初温150 ℃,以30 ℃/min速率,升至260 ℃保持2 min,再以3 ℃/min速率,升至300 ℃保持 2 min;FID检测器温度320 ℃。
(2)红外测试条件。使用KBr与样品以质量比约100∶1进行混合研磨压片,检测器:DTGS,谱图采集范围400~4 000 cm-1,扫描次数32次。
(3)气质联用测试条件。环己烷为溶剂,氦气为载气,色谱柱为HP-5毛细管柱,进样温度 310 ℃,柱流量0 .8 mL/min,分流比50∶1,初始炉温100 ℃,以20 ℃/min升温速度,升至300 ℃保持5 min。质谱离子源类型:EI源;离子化电压:70 eV。
(4)1H-NMR 测试条件。氘代氯仿为溶剂,观察频率为500 MHz,谱宽为10 000 Hz,测试温度为25 ℃,脉冲角30°,脉冲重复时间为1.0 s,采样64次。
(5)13C-NMR测试条件。氘代氯仿为溶剂,观察频率为125 MHz,谱宽为37 878 Hz,测试温度为25 ℃,脉冲角30°,脉冲重复时间为2.0 s,采样 1 024 次。
(6)二维谱测试条件。gCOSY采用Bruker公司标准脉冲程序。gCOSY中F1域谱宽为10 000 Hz,2 048×2 048采样数据矩阵,延迟时间为2 s。
2 结果与讨论
2.1 样品的气相色谱分析及质谱分析表征
图1酰基化产物气相色谱对比图表明酰化合成产物粗品中除了目标产物主产物峰(出峰时间为19.59 min)外,还含有少量其他杂质峰,酰化合成产物目标产物峰积分比例为89.98%。经过重结晶处理后的酰化产物纯品,色谱图中仅有1个酰化合成产物目标峰,未见其他杂质峰的出现,纯度为99.99%。由此可以判断,从气相色谱分析结果得到酰化合成粗品经过甲醇水溶液重结晶处理后,可获得纯度较高的酰化合成产物。
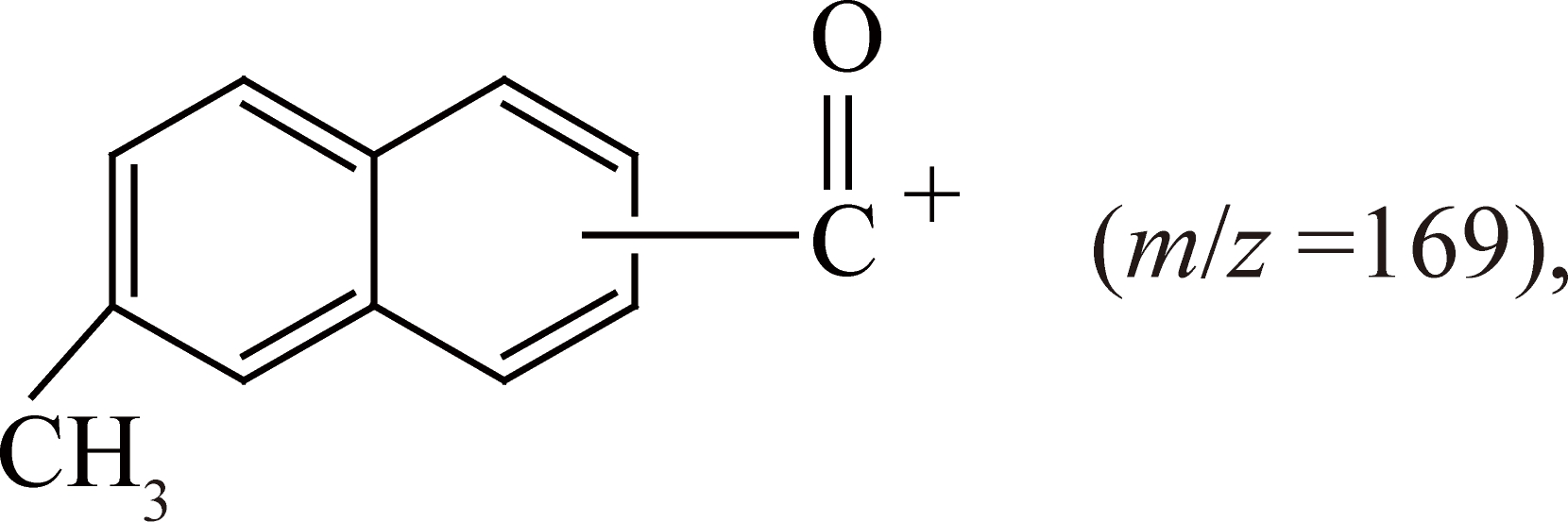
为了进一步确认酰化产物的分子结构,对酰化产物纯品进行了GC-MS分析。图2(a)为酰化产物纯品GC-MS分析对应的气相色谱图,17.2 min处只有目标产物的单一峰,进一步说明获得的目标产物纯度较高。图2(b)为目标产物的质子离子棒图,可以得到该物质在EI中裂分的离子碎片分子量情况。图2中m/z=198的分子离子峰与2-甲基-6-丙酰基萘(或2-甲基-7-丙酰基萘)的分子量相同。结合2-甲基-6-丙酰基萘的分子结构并通过对离子碎片峰的分析,可以推测该物质的裂解途径如下所示:
2-甲基-6-丙酰基萘(或2-甲基-7-丙酰基萘)(m/z=198)先电离解析—CH2CH3·,得到:
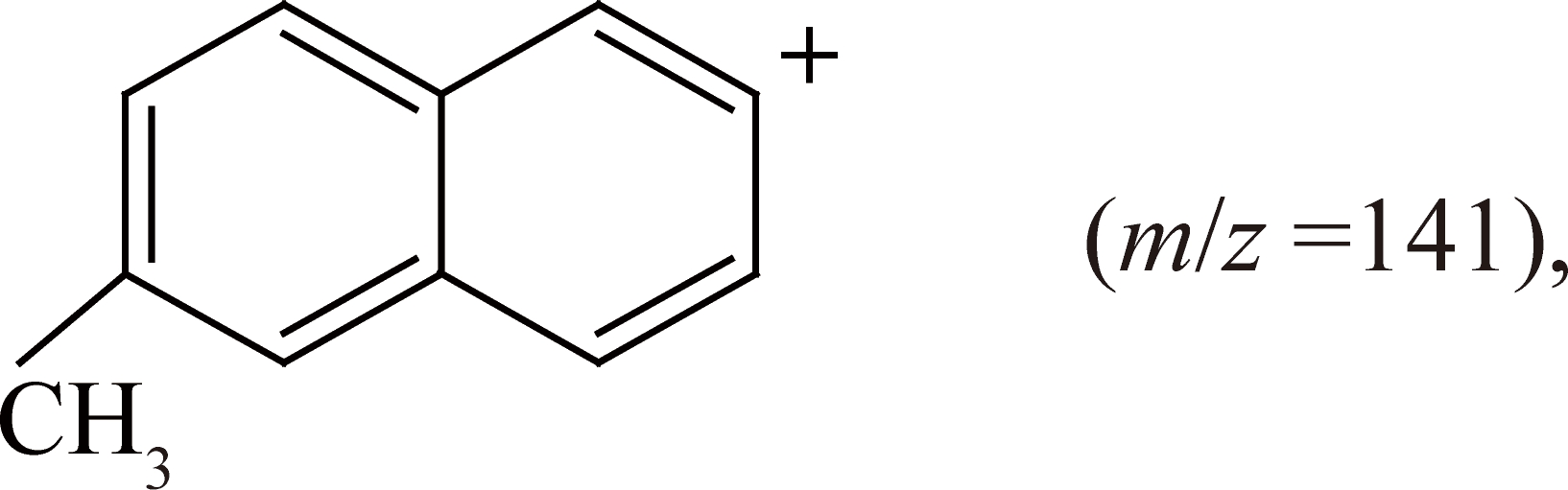
再解离—CO,得到
发生重排反应获得
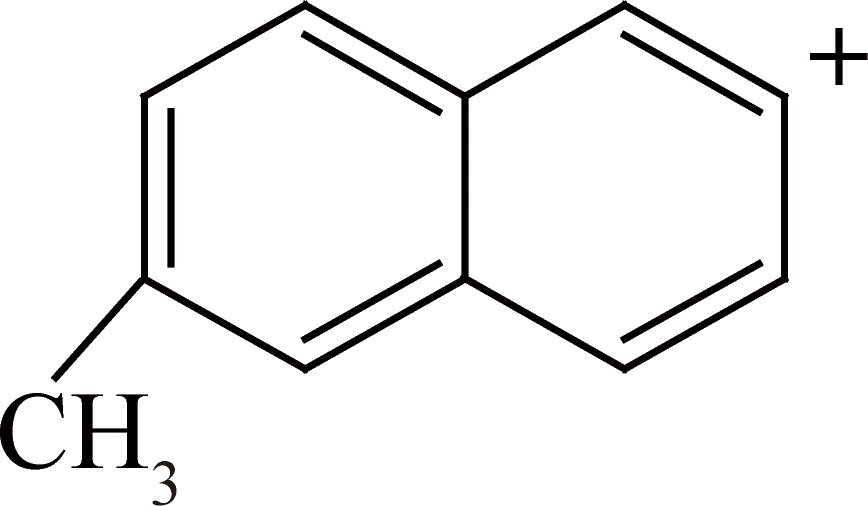
再解离—HC≡CH,得到离子碎片
此质谱数据可验证该化合物为甲基和丙酰基的二取代萘,但无法判断丙酰基在萘环上的位置。
2.2 酰化合成产物红外及核磁共振波谱表征分析
为了剖析酰化产物纯品的官能团信息,进一步对样品进行了相应的红外分析。图3为2-甲基萘和酰化产物纯品的红外谱图,通过比较2-甲基萘的红外谱图可知酰化产物纯品在1 680 cm-1处有很强的吸收峰,证明该物质中含有羰基官能团。2-甲基萘的红外谱图中,在740,765 cm-1存在强的吸收谱峰,该谱峰为萘环上4个相邻氢的C—H面外弯曲振动峰,而在酰化产物纯品的红外谱图中765~735 cm-1处的谱峰并不存在,说明酰化产物纯品在另1个环上发生了取代反应。酰化产物纯品在3 051 cm-1处有较强的吸收谱峰,为萘环上的C—H弱的伸缩振动特征峰,1 250 cm-1处有较强的吸收谱峰是亚甲基的扭曲变形振动吸收谱峰,在2 980,2 940,2 970 cm-1处有3个吸收峰,这3个峰是萘环上对应的2个甲基和1个亚甲基上的伸缩振动吸收谱峰。以上说明萘环上有2个取代基,其中1个为甲基官能团,另一个则是含有亚甲基的取代基,其解析结构与目标产物结构相一致。
为了对所得到的酰化产物纯品的分子结构中骨架原子信息进行剖析,进行了相应的核磁共振1H-NMR和13C-NMR。
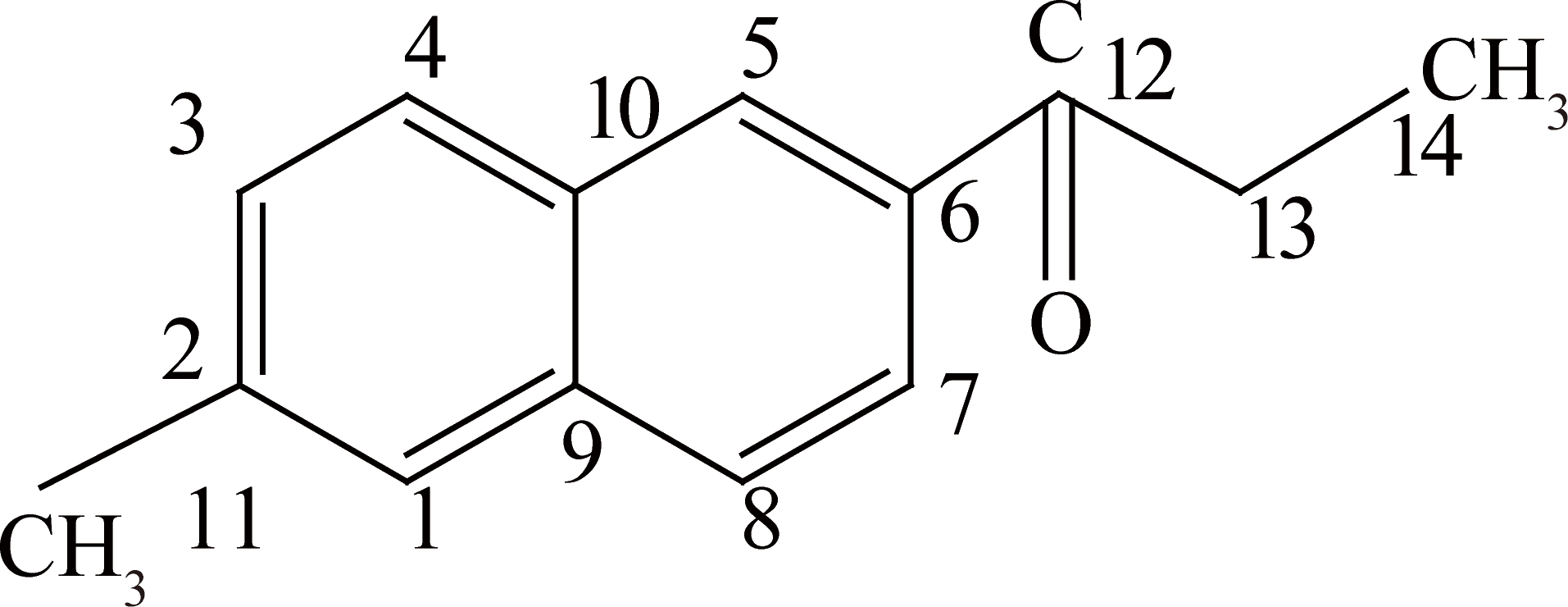
2-甲基-6-丙酰基萘的结构通式及原子编号为
图4,5为化合物的1H-NMR和质子同核相关二维谱(gCOSY),1H-NMR谱解析中1H-NMR(500 MHz, CDCl3)δ8.42(s,1H),8.21~7.05(m,5H),3.11(d,J=7.3 Hz,2H),2.53(s,3H),1.27(t,J=7.3 Hz,3H)。由丙酰基对芳环邻位氢的低场位移作用及萘环迫位氢(5位及8位)受到的强去屏蔽作用,δ8.42处的氢应为5位或8位。δ1.27和δ2.53的2个单峰分别来自甲基14和甲基11,而δ3.11的单峰来自于—C O相邻的亚甲基13。由gCOSY得到,δ0.50~δ5.00的脂肪烃区质子峰显示出1个耦合体系,δ1.29与δ3.12自旋耦合,推测此耦合为与—C
O相邻的亚甲基13。由gCOSY得到,δ0.50~δ5.00的脂肪烃区质子峰显示出1个耦合体系,δ1.29与δ3.12自旋耦合,推测此耦合为与—C O相邻的亚甲基与甲基的质子峰自旋耦合。δ7.00~δ8.40的芳环上质子峰显示出2个耦合体系,δ7.39与δ7.82,δ7.80与δ8.02相互耦合,推断确定这2个取代基应分别处于2个芳环上,且取代基位置应为2或3及6或7。已知甲基处于2位,则丙酰基应位于6或7位置。δ2.55与δ7.64远程耦合,故δ2.55和δ7.64 应分别为H11和H1。结合1H-NMR和质子同核相关二维谱(gCOSY),可推测化合物的分子结构中各质子氢的化学位移如下所示:
O相邻的亚甲基与甲基的质子峰自旋耦合。δ7.00~δ8.40的芳环上质子峰显示出2个耦合体系,δ7.39与δ7.82,δ7.80与δ8.02相互耦合,推断确定这2个取代基应分别处于2个芳环上,且取代基位置应为2或3及6或7。已知甲基处于2位,则丙酰基应位于6或7位置。δ2.55与δ7.64远程耦合,故δ2.55和δ7.64 应分别为H11和H1。结合1H-NMR和质子同核相关二维谱(gCOSY),可推测化合物的分子结构中各质子氢的化学位移如下所示:
目标产物的1H-NMR谱图及质子化学位移与Chemdraw预测的2-甲基-6-丙酰基萘核磁谱图相比,考虑由于溶剂效应的影响所导致的化学位移偏差,二者非常接近(图6)。
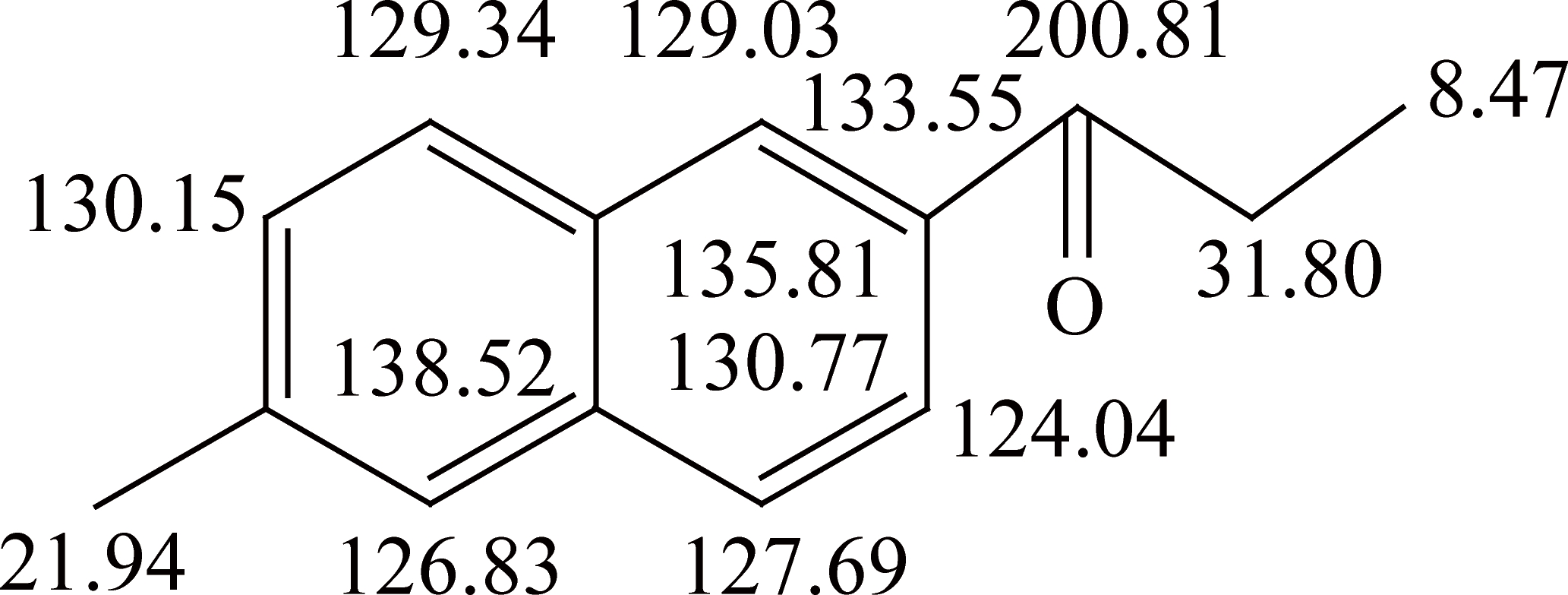
化合物的13C-NMR谱(图7)在(10~0)×10-6的脂肪碳区显示有2个甲基峰δ8.47和δ21.94,还含有一个亚甲基峰δ31.80。芳碳区(100~170)×10-6萘环部分有6个叔碳原子和4个季碳原子的峰,δ200.81为羰基碳。根据13C-NMR 谱的解析推测化合物的分子结构中各碳原子的化学位移为
目标产物的13C-NMR谱图及碳原子化学位移与利用Chemdraw软件预测的2-甲基-6-丙酰基萘碳核磁谱图(图7)几乎一致,结合1H-NMR谱图实测谱图和预测谱图,可以推断合成的目标产物为2-甲基-6-丙酰基萘。
2.3 酰化合成反应过程探索
Friedel-Crafts酰基化反应是指在Lewis酸或者质子酸的催化下,酰化剂与芳烃发生环上亲电取代反应。当选择Lewis酸AlCl3作为β-甲基萘的酰化催化剂时,酰化反应机理为Friedel-Crafts亲电取代反应,即在催化剂作用下生成正碳离子,丙酰氯对萘环进行亲电取代反应得到高选择性的2-甲基-6-丙酰基萘,反应历程如下:
实验得到,在AlCl3催化剂作用下,在丙酰氯过量的前提下β-甲基萘的转化率为92.53%,产物中2-甲基-6-丙酰基萘的选择性达89.98%。2-甲基萘经AlCl3催化酰化反应后主要生成2-甲基-6-丙酰基萘,而不是生成同环邻位取代产物,这是因为Friedel-Crafts酰化反应与其他芳香取代反应(如硝化、卤化及C-烷基化)相比,萘环受到了酰基化基团的钝化作用,邻位的选择性要小得多,这种现象是由于酰化剂与催化剂形成的活化络合物体积较大造成的空间位阻引起的[20]。
3 结 论
(1)以2-甲基萘为原料,AlCl3为催化剂,丙酰氯为酰化剂,硝基苯为溶剂,在原料物质的量比为β-甲基萘∶丙酰氯∶三氯化铝=1.0∶1.4∶1.7条件下,25 ℃下反应5 h,β-甲基萘的转化率为92.53%,选择性达89.98%,且通过甲醇重结晶处理可获得99.99%化合物纯品。
(2)酰化产物纯品分子结构经红外、质谱、1H-HMN、13C-HMN、gCOSY二维核磁联合表征解析,确认为2-甲基6-丙酰基萘。
(3)酰化剂与催化剂形成的活化络合物所引起的空间位阻使得2-甲基萘经AlCl3催化酰化反应后主要生成2-甲基-6-丙酰基萘。
参考文献(References):
[1] 刘万治,谢刚.PEN及其中间体2,6-萘二甲酸简介[J].聚酯工业,2006(4):7-10.
LIU Wanzhi,XIE Gang.Introduction of PEN and its intermediate 2,6-NDA[J].Polyester Industry,2006(4):7-10.
[2] 宋厚春,陆军.聚萘二甲酸乙二醇酯(PEN)的研究及发展[J].合成技术及应用,2003,18(2):17-20.
SONG Houchun,LU Jun.Research and development of PEN[J].Synthetic Technology and Application,2003,18(2):17-20.
[3] 何志荣,张俐霞,朱凌皓.2,6-萘二甲酸及其酯的制备和应用[J].煤化工,2001,1(1):51-56.
HE Zhirong,ZHANG Lixia,ZHU Linghao.preparation and application of 2,6-naphthalene dicarboxylic acid and dimethyl-2,6 naphthalene dicarboxylate[J].Coal Chemical Industry,2001,1(1):51-56.
[4] 徐兆瑜.21世纪的新型高分子材料—聚萘二甲酸乙二醇酯(PEN)[J].化学推进剂与高分子材料,2002(2):11-15.
XU Zhaoyu.A new type of polymer materials in the 21st century-polyethylene naphthalate(PEN)[J].Chemical Propellants & Polymeric,2002(2):11-15.
[5] 白雪峰,吴伟,胡浩权.2,6-二甲基萘的制备方法[J].现代化工,2003,23(10):13-16.
BAI Xuefeng,WU Wei,HU Haoquan.Preparation methods of 2,6-dimethylnaphthalene[J].Modern Chemical Industry,2003,23(10):13-16.
[6] 徐晓辉,马晓峰,胡宝军.2,6-萘二甲酸乙二醇酯(BHEN)缩聚反应工艺研究[J].技术与教育,2013,27(2):10-15.
XU Xiaohui,MA Xiaofeng,HU Baojun.Progress research of 2,6-naphthalene two formic acid glycol ester (BHEN) Polycondensation[J].Technology and Education,2013,27(2):10-15.
[7] ZHU H,MEYER M P.Cationic intermediates in friedel-crafts acylation:Structural information from theory and experiment[J].Chemical Communications,2010,47(1):409-411.
[8] KREITMAN K M,BREWER S E,RODDEN J B,et al.An integrated process for the production of 2,6-naphthalene dicarboxylic acid[P].US:6448436,2002.
[9] 吴红辉,李玉琦.2,6-萘二甲酸的合成探讨[J].上海化工,1999(6):3-5.
WU Honghui,LI Yuqi.Synthesis of naphthalene dicarboxylic acid[J].Shanghai Chemical Industry,1999(6):3-5.
[10] 刘亮.2-甲基萘酰化氧化反应合成2,6-萘二甲酸的研究[D].抚州:东华理工大学,2012.
LIU Liang.2,6-naphthalenedicarboxylic acid preparation of 2-methy naphthalene acylation and oxidation reaction[D].Fuzhou:East China University of Technology,2012.
[11] TACHIBANA Y,TATE K,ONO M,et al.Process for the preparation of naphthalene carboxylic acids[P].US:5055612,1991.
[12] MITAMURA S,FUJISHIRO K,INOUE H.Process for preparation of naphthalene 2,6-dicarboxylic acid dialkalic metal salts[P].US:4820868,1989.
[13] 夏清,阮湘泉,郑嘉明,等.Co-Mn-Br催化氧化2,6-二烷基萘制2,6-萘二甲酸的研究进展[J].化学工业与工程,1997(4):27-33.
XIA Qing,RUAN Xiangquan,ZHENG Jiaming,et al.The trend of the production of 2,6-naphthalene dicarboxylic acid by Co-Mn-Br catalgtic oxidation of 2,6-dialkyl naphthalene[J].Journal of Chemical Industry and Engineering,1997(4):27-33.
[14] 靳立军.2-甲基萘与甲醇烷基化选择性合成2,6-二甲基萘研究[D].大连:大连理工大学,2006.
JIN Lijun.Selective synthesis of 2,6-dimethyl naphthalene by methylation of 2-methylnaphthalene with methanol[D].Dalian:Dalian University of Technology,2006.
[15] 栾珊.介孔ZSM-5的合成及在2-甲基萘甲醇烷基化中的应用[D].大连:大连理工大学,2013.
LUAN Shan.Synthesis of mesoporous ZSM-5 and its application in alkylation of 2-methylnaphthalene with methanol[D].Dalian:Dalian University of Technology,2013.
[16] 张绍中,张新建,周小野,等.煤焦油中质洗油中提取2,6-二甲基萘的反应研究[J].当代化工,2018,47(10):2037-2040.
ZHANG Shaozhong,ZHANG Xinjian,ZHOU Xiaoye,et al.Study on the reaction of extracting 2,6-dimethylnaphthalene from coal tar intermediate wash oil[J].Contemporary Chemical Industry,2018,47(10):2037-2040.
[17] 舒歌平,陈鹏,李文博,等.从煤焦油中提取2,6-二甲基萘反应条件的研究[J].煤炭学报,1999,24(1):3-5.
SHU Geping,CHEN Peng,LI Wenbo,et al.Study on reaction conditions for extraction of 2,6-dimethyl naphthalene from coal tar[J].Journal of China Coal Society,1999,24(1):3-5.
[18] 舒歌平,陈鹏,李文博,等.从煤焦油中提取2,6-二甲基萘反应的机理研究[J].煤炭学报,1999,24(2):3-5.
SHU Geping,CHEN Peng,LI Wenbo,et al.Study on mechanism of extraction of 2,6-dimethyl naphthalene from coal tar[J].Journal of China Coal Society,1999,24(2):3-5.
[19] 李文博,舒歌平,陈鹏,等.乳化液膜结晶提纯精制2,6-二甲基萘的研究[A].中国煤炭学会青年科技学术研讨会论文集[C].北京:煤炭工业出版社,2000:344-349.
LI Wenbo,SHU Geping,CHEN Peng,et al.Emulsion membrane crystallization purification refined 2,6-dimethyl naphthalene research[A].Youth Conference on Science and Technology of China Coal Society[C].Beijing:China Coal Publish House,2000:344-349.
[20] 刘亮,杨索和,靳海波,等.2-甲基萘酰基化反应研究[J].化学工业与工程,2012,29(2):20-23.
LIU Liang,YANG Suohe,JIN Haibo,et al.Catalytic characteristics of 2-methylnaphthalene acidylation[J].Chemical Industry and Engineering,2012,29(2):20-23.
[21] 王沛,蹇锡高.2-甲基6-酰基萘的合成[J].大连海事大学学报,2008,34(1):99-102.
WANG Pei,QIAN Xigao.Synthesis of 2-methyl 6-acylnaphthalene via acylation with 2-methylnaphthalene[J].Journal of Dalian Maritime University,2008,34(1):99-102.
[22] 王国房.焦化洗油制备高效水煤浆添加剂研究[J].煤质技术,2016(1):30-33.
WANG Guofang.Research on using coking oil to do the preparation of high efficient coal water slurry additives[J].Coal Quality Technology,2016(1):30-33.
 2,6-萘二甲酸(2,6-NDA)是合成聚酯新材料聚萘二甲酸乙二醇酯(PEN)的重要单体,2,6-NDA结构的高度对称性使得PEN具有直链聚合物的特性,这种特性使得PEN在耐热性、阻气性能和化学稳定性等方面具备非常优越的性能。2,6-NDA的合成可通过氧化2-甲基-6-酰基萘得到,其制备过程中的关键步骤为β-甲基萘的酰基化反应。为了揭示β-甲基萘的酰基化反应过程和机理,以Lewis酸AlCl3为催化剂,采用丙酰氯和硝基苯分别作为酰化剂和溶剂对β-甲基萘的酰基化反应进行详细研究。β-甲基萘的酰基化反应结果表明,25 ℃下控制原料物质的量比n(β-甲基萘)∶n(丙酰氯)∶n(AlCl3)=1.0∶1.4∶1.7,在丙酰氯过量的前提下酰化反应5 h,β-甲基萘的转化率为92.53%,目标产物选择性达89.98%,反应得到的酰化粗品用15%的甲醇水溶液进行重结晶精制可得到纯度为99.99%的酰化纯品。采用气相色谱(GC)、质谱(MS)、红外(IR)、核磁(1H-NMR、13C-NMR)及二维核磁解析(gCOSY)对酰化纯品的分子结构进行了详细表征,分析了酰基化产物的官能团信息和分子结构骨架原子信息。结合Chemdraw软件的结构预测对比确认了酰化产物为2-甲基-6-丙酰基萘。β-甲基萘酰化机理分析表明,酰化剂与催化剂形成的活化络合物分子具有较大的尺寸,在进行Friedel-Crafts酰基化反应时,酰化剂与芳烃发生环上亲电取代反应所引起的空间位阻使得酰化剂只能进攻萘环的6号位,导致酰基化反应主要生成2-甲基-6-丙酰基萘。
2,6-萘二甲酸(2,6-NDA)是合成聚酯新材料聚萘二甲酸乙二醇酯(PEN)的重要单体,2,6-NDA结构的高度对称性使得PEN具有直链聚合物的特性,这种特性使得PEN在耐热性、阻气性能和化学稳定性等方面具备非常优越的性能。2,6-NDA的合成可通过氧化2-甲基-6-酰基萘得到,其制备过程中的关键步骤为β-甲基萘的酰基化反应。为了揭示β-甲基萘的酰基化反应过程和机理,以Lewis酸AlCl3为催化剂,采用丙酰氯和硝基苯分别作为酰化剂和溶剂对β-甲基萘的酰基化反应进行详细研究。β-甲基萘的酰基化反应结果表明,25 ℃下控制原料物质的量比n(β-甲基萘)∶n(丙酰氯)∶n(AlCl3)=1.0∶1.4∶1.7,在丙酰氯过量的前提下酰化反应5 h,β-甲基萘的转化率为92.53%,目标产物选择性达89.98%,反应得到的酰化粗品用15%的甲醇水溶液进行重结晶精制可得到纯度为99.99%的酰化纯品。采用气相色谱(GC)、质谱(MS)、红外(IR)、核磁(1H-NMR、13C-NMR)及二维核磁解析(gCOSY)对酰化纯品的分子结构进行了详细表征,分析了酰基化产物的官能团信息和分子结构骨架原子信息。结合Chemdraw软件的结构预测对比确认了酰化产物为2-甲基-6-丙酰基萘。β-甲基萘酰化机理分析表明,酰化剂与催化剂形成的活化络合物分子具有较大的尺寸,在进行Friedel-Crafts酰基化反应时,酰化剂与芳烃发生环上亲电取代反应所引起的空间位阻使得酰化剂只能进攻萘环的6号位,导致酰基化反应主要生成2-甲基-6-丙酰基萘。