生物成因煤层气对低煤阶煤层气资源有显著贡献,低煤阶煤层气以有机成因为主,主要包括生物成因气、生物-热催化过渡带气和热成因气[1-3]。生物成因气作为低煤阶煤层气主要的成因类型,又进一步分为原生生物气和次生生物气,在国内外许多中低煤阶含煤岩系发现了次生生物成因气的存在,如美国的Powder和San Juan盆地[4]、澳大利亚的Sydney和Bowen盆地[5-6]、波兰的Upper Silesian和Lublin盆地[7]、加拿大的Elk Valley煤田[8],以及我国山西李雅庄、云南洪恩、淮南以及淮北[9-13]等地先后发现经本源菌降解产生的次生生物成因煤层气,且多集中于中低煤阶煤层中。生物成因煤层气产生的功能型本源菌主要为古菌(Archaea),是生成甲烷主要的功能微生物,甲烷八叠球菌、甲烷微菌及甲烷杆菌等菌属在美国Powder和San Juan盆地煤层气田、我国淮北芦岭煤田和晋城沁水盆地中陆续发现[14],产气途径也由早期发现的氢营养型和甲基类营养型更迭到近期发现的甲氧基芳香族化合物营养型[15],产气途径是影响生物气组分和同位素组成上差异的重要因素。王爱宽等[16-17]曾利用云南省昭通褐煤中的本源菌进行生物产气实验,研究认为乙酸发酵和CO2还原两种产气途径均有参与,产气组分以CO2和CH4为主,δ13C1和δD均处在生物气正常范围,δ13C1存在变轻的趋势,甲烷生成途径、母源继承关系和显微组分构成是产气主控因素。针对甲氧基芳香族化合物营养型,DAISUKE等[15]稳定同位素示踪实验显示,煤制生物气过程中δ13C1的逐渐变重与甲氧基的13C含量的增加密切相关,甲氧基中的13C被分馏到甲烷中。
此外,环境介质对生物气同位素组成有较大影响,WOLTEMATE 等[18]研究认为,虽然总体CO2还原成因甲烷比乙酸发酵的更富氘同位素,但甲烷中氢同位素组成受环境介质中氢同位素的影响较为显著。总的来说,淡水环境比咸水环境中形成的甲烷更富13C,贫氘,分馏效应明显;淡水环境生物甲烷产出多以甲基类发酵为主,咸水环境生物甲烷产出多以CO2还原为主,WHITICAR等[19]研究发现甲基类发酵成因的生物甲烷中有1/4的氢来源于水介质,3/4的氢源自于甲基,由于甲基氢相对于水介质中的氢具有较轻的同位素组成,反而使得CO2还原成因甲烷的δD值更重。
前人利用生物作用于煤产生甲烷来模拟生物成因煤层气产生过程由来已久,在煤制生物气产量、途径、构成及机理上做出较多有益探索[20-25],但总体对煤制生物气过程中产气和同位素分馏效应方面鲜有普适应规律。基于此,笔者选取低阶煤作为煤制生物气的母质,采用厌氧全封闭模式开展本源菌作用生气模拟,着重分析产气量、气体组分及其碳氢同位素组成变化规律,探究同位素分馏效应,以期在煤本源菌作用生气规律上有更深入的认识,完善生物成因煤层气机理。
1 样品和实验
选取吐哈盆地大南湖煤矿西山窑组的褐煤(编号分别为H1和H3)与阜康矿区大黄山八道湾组的长焰煤(编号为CY)作为煤岩生物气模拟的源岩。煤岩的基本性质的测试见表1,3件煤样处于未熟或低熟阶段,其中腐植组/镜质组为主要的有机显微组分,均在60%以上,惰质组与稳定组/壳质组含量基本相当,此外褐煤样的黏土矿物含量总体要高于长焰煤样。
表1 煤样显微组分和工业分析测试结果
Table 1 Results of macerals and industrial analysis of coal samples%

样品编号Ro,max有机显微组分(去矿物基)腐植组/镜质组惰质组稳定组/壳质组黏土矿物工业分析MadAadVdafFCdafH10.3467.318.814.013.46.576.6646.3053.70H30.3563.416.819.911.07.7412.7841.8658.14CY0.5362.221.616.35.01.424.5833.2166.79
煤样自然晾干后将其研磨至100~120目进行接种,携带产甲烷菌的煤层矿井水经过富集培养后的菌种液为本文的菌源。富集培养时,其营养成分配置与产气模拟时的相同(具体见下文),需要注意的是,为了除去培养基中的氧,需要用滴管加入2~3滴1%Na2S和5%NaHCO3混合溶液,将富集培养瓶置于HZQ-F160型全温振动培养箱中,温度设定为37 ℃,富集培养30 d。富集培养结果显示,菌群在门的水平上主要由变形菌门、厚壁菌门、拟杆菌门以及螺旋体门构成,尤其是螺旋体门中的螺旋体属中包含较多的产氢产乙酸菌,这类菌群可将碳水化合物转化为产甲烷菌直接利用的乙酸、氢气以及二氧化碳等;此外产甲烷菌的优势菌属主要为甲烷杆菌属和甲烷八叠球菌属组成。
产气模拟时将3件煤样分为4组,每组微生物作用降解产气的时间分别为30,50,70,90 d,产气瓶按微生物作用煤岩时间的不同分别标记为H1-30,H3-30,CY-30;H1-50,H3-50,CY-50;H1-70,H3-70,CY-70;H1-90,H3-90,CY-90,接种在高纯氮气的环境中进行,向500 mL厌氧瓶(反应瓶)中加入40 g煤样、20 mL菌种液、380 mL培养基,培养基的配置如下:
(1)每1 000 mL无菌水中加入K2HPO4 0.4 g,MgCl2 2.0 g,KH2PO4 0.4 g,酵母浸入液 1.0 g,NH4Cl 1.0 g,刃天青0.001 g,乙酸钠2.0 g、半胱氨酸0.5 g,KCl 0.2 g,NaCl 2.0 g、微量元素溶液10.0 mL。
(2)微量元素溶液:每1 000 mL无菌水中加入MgCl2·6H2O 5.0 g,FeCl2·4H2O 6.0 g,CoCl2·6H2O 0.15 g,H3BO3 0.1 g,ZnSO4·7H2O 0.1 g,CuSO4·5H2O 0.05 g,NiSO4·6H2O 0.45 g,MnCl2·4H2O 5.0 g,(NH4)6Mo7O24·4H2O 0.64 g、刃天青0.001 g。
调节溶液pH值至7.4。并设立空白对照组(CK-90),空白对照组除了不添加煤样外,其他均相同。接种完成后将反应瓶置于全温振动培养箱中,在设定温度37 ℃下进行振动培养产气。整个生物气产出模拟最长时间为90 d,每隔10 d采用快速排水集气方式记录产气量,分析产出气的组分及百分含量,分别在30,50,70,90 d这4个时间节点测试气体碳氢同位素组成。采用KV-CMC0051型气相色谱仪开展产气组分和含量测试,每次检测利用注射器抽取产气瓶气体量为5 mL,测试过程中检测温度为250 ℃,色谱柱温度为55 ℃,载气为205 kPa的氦气。产气同位素分析中,碳同位素依据标准GB/T 18340.2—2010,氢同位素依据标准Q/WX0006—2006,采用DELAT V Plus型稳定同位素质谱仪开展测试。
2 结果与讨论
2.1 煤岩生物气组分特征及产气规律
经气相色谱检测,本次煤微生物作用生气的主要成分为CH4和CO2,以及含有极少量的H2。微生物作用的整个过程中基本没有检测到重烃气的存在,可见模拟的生物成因气与天然气一样以干气为主。
由表2可知,整个微生物作用生气过程中,褐煤H1的4个产气瓶中CH4含量介于0.31%~18.60%,CO2含量介于9.27%~26.11%;褐煤H3的4个产气瓶中CH4含量介于0.56%~24.45%,CO2含量介于7.70%~23.66%;长焰煤CY的4个产气瓶中CH4含量介于1.36%~33.39%,CO2含量介于7.47%~10.58%。在不同生气阶段,两者所占的比例不同,由图1可知,在30 d之前的阶段是产气的非稳定区,3组产气瓶中CH4和CO2含量总体是增大的,但缺乏规律性,30 d之后才进入相对稳定的产气阶段,两者含量变化的规律性才显现出来。在稳定产气阶段(30~90 d),3组产气瓶均呈现了相同的变化规律,不论是CH4还是CO2,均随着微生物作用时间的增长,其含量总体表现出先减小后增大再减小的趋势;即,在30~60 d时,3组产气瓶中CH4和CO2含量先降低后升高,60 d以后再次降低(图1)。
表2 煤制生物气中CH4和CO2含量
Table 2 Contents of CH4 and CO2 in biogenic gas made from coal%

产气瓶编号测试气体产气时间/d102030405060708090H1-30CH40.314.7810.36——————CO216.3019.6718.72——————H1-50CH40.355.6910.998.918.75————CO217.2720.9321.6518.9819.89————H1-70CH40.430.955.324.764.838.587.54——CO213.9819.2022.5319.0819.9126.1125.21——H1-90CH40.852.1514.3712.3711.5218.6017.5817.4113.99CO217.1116.8318.8316.2416.6921.4221.5922.379.27H3-30CH40.5613.2314.39——————CO27.7017.6315.69——————H3-50CH43.9316.6716.3914.2213.96————CO217.9817.8320.1317.6818.81————H3-70CH42.1015.7716.6013.7113.8420.4120.19——CO216.4217.3019.0816.1116.7421.0120.87——H3-90CH41.2814.1315.4813.0513.3222.5622.2824.4515.13CO215.3717.6819.1416.9417.4021.6721.6223.6611.95CY-30CH41.3616.8217.27——————CO28.159.308.89——————CY-50CH45.6916.0118.8816.9717.85————CO29.098.479.107.918.05————CY-70CH412.5817.4219.2416.9217.5528.4328.27——CO210.268.449.337.477.7210.269.86——CY-90CH410.6620.7922.9020.5121.5233.3932.4332.9931.91CO210.238.699.457.768.0110.4610.0310.587.66

图1 煤制生物气中CH4和CO2含量变化曲线
Fig.1 Change curves of CH4 and CO2 content in biogenic gas made from coal
上述表明,进入稳定产气期后CH4和CO2含量的变化显示出明显的同步性或者协同性。在现有发现的生物气产出途径中,只有乙酸分解才能使CH4和CO2含量的变化出现同步规律,因此可以推测此次煤微生物作用产气的主要途径可能与乙酸发酵分解有关。另一方面,曾有研究表明,褐煤本源菌微生物作用产气中,如果以腐植组为第1产气周期,其产出气中CO2含量高于CH4,如果是以惰质组和稳定组为第1产气周期,其CH4含量会高于CO2[16]。可以推测,本次褐煤生气可能以降解腐植组为主,长焰煤生气可能以降解惰质组和稳定组为主,煤岩有机显微组分是影响微生物作用的重要因素;除此以外,微生物的数量、活性和繁殖程度、环境的酸碱性、氧化还原反应电位、微生物作用生气方式等也是重要的影响因素,能直接影响产气组分与其变化规律。
为了探求煤中的有机质生气特征,对实验产气量数据进行了校正和分析,有
qj=qo-qck
(1)
Qr=qj/[m(1-Aad-Mad)]
(2)
式中,qj为校正后产气量,mL;qo为原始产气量,mL;qck为空白组(CK)的产气量,mL;Qr为煤中有机质产气率,mL/g;m为煤样质量,g。
本次煤制生物气产气量与有机质产气率计算结果见表3,空白组(CK-90)在稳定产气期前有较大的产气量,甚至一度超过CY-90的产气量,之后空白组产气量迅速衰减消失为零,产气量的变化一定程度上反映了微生物的数量和活性,但同时产气瓶中可能存在不少数量的无机气和非生物成因的有机气。进入稳定产气阶段以后,3组产气瓶(H1-90,H3-90,CY-90)校正后的产气量和有机质产气率均经历了先增大后减小再增大的过程,与此变化同步的是产气瓶中溶液的pH值,经检测3组产气瓶中的pH值在产气稳定期也表现出先增大后减小再增大的趋势(图2)。
这说明,溶液体系中的酸碱性明显影响了微生物的活性,由于煤层矿井水本源菌中水解发酵菌和产酸菌的存在,稳定产气期之前溶液中已经存在脂肪酸、氨基酸、甲酸等酸性物质,此时体系中的pH值是降低的,之后的稳定产气阶段经过产甲烷菌对这些酸性物质的分解利用,使得体系中的pH值增高,产气过程中产酸微生物与产甲烷菌的数量和活性直接影响了溶液的酸碱性和最终的产气量。
2.2 煤制生物气同位素分馏与机理分析
天然气组分和碳氢同位素组成是判识其成因的主要手段。大量的研究显示,自然界中生物成因煤层气中甲烷含量较高,重烃气(C2+)含量甚微,气体偏干,生物有机成因甲烷一般富含12C,甲烷碳同位素组成偏轻,δ13C1值一般小于-55‰,δD1值分布范围较宽,多数情况下小于-200‰,此外自然界中有机成因的δ13C(CO2)值小于-10‰,无机成因时δ13C(CO2)值一般大于-8‰[3,26]。本次煤制生物气碳氢同位素测试结果表明,δ13C1值介于-69.8‰~-56.5‰,平均为-60.98‰;δ13C(CO2)值介于-20.8‰~-10.7‰,平均为-16.38‰;δD1值介于-361‰~-332‰,平均为-348‰(表4)。可见甲烷碳氢同位素组成与二氧化碳碳同位素组成均符合有机成因气的标准,由此可以判定本次模拟产气组分中的CH4和CO2为生物有机气。
表3 煤制生物气的产气量与有机质产气率
Table 3 Gas production and gas yield of organic matter in biogenic gas made from coal
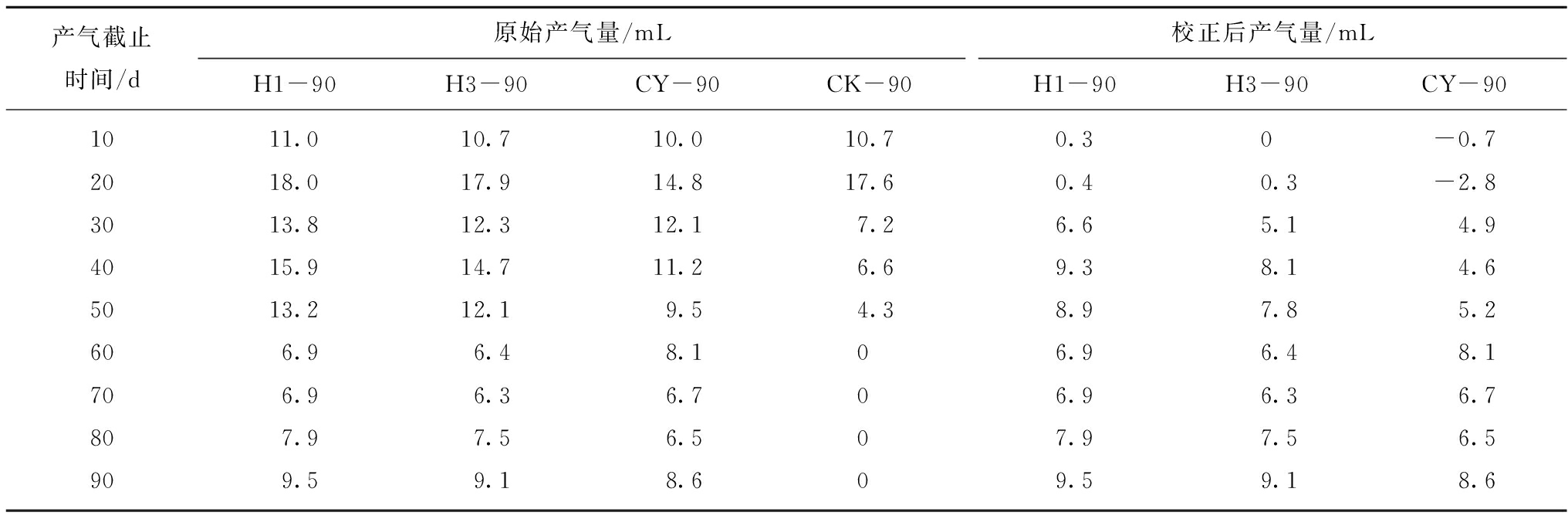
产气截止时间/d原始产气量/mLH1-90H3-90CY-90CK-90校正后产气量/mLH1-90H3-90CY-901011.010.710.010.70.30-0.72018.017.914.817.60.40.3-2.83013.812.312.17.26.65.14.94015.914.711.26.69.38.14.65013.212.19.54.38.97.85.2606.96.48.106.96.48.1706.96.36.706.96.36.7807.97.56.507.97.56.5909.59.18.609.59.18.6

图2 进入稳定产气期后的产气量与产气率变化规律
Fig.2 Change laws of gas production and gas yield after entering the gas production stable period
一方面,δ13C1-δD1图解显示(图3),本次煤微生物作用生气途径主要为乙酸发酵作用,这也说明了CH4和CO2含量为什么会出现协同式变化规律;另一方面,由图4表明,随着微生物作用时间的延长,产出气中CH4的碳同位素变的越来越轻,而CO2的碳同位素却表现出越来越重,两者之间呈现了明显的负相关性,这可能与继承性同位素效应密切相关。GALIMOV[27]和JAMES[28]研究认为,天然气的生成和同位素组成对生气母质和干酪根具有明显的继承效应。煤中不同结构的碳同位素组成受控于生物先质碳同位素组成和干酪根在形成和演化过程中的同位素分异效应。煤作为典型的Ⅲ型母质含有较多的芳香族物质和相当数量的不同种类的官能团(侧链),其中芳核的13C丰度高于类脂侧链,芳香族物质一般富含13C,类脂物质一般富含12C,就造成总体的碳同位素组成具有δ13C(干酪根)>δ13C(芳香核)>δ13C(类脂侧链)特点[29]。一方面,微生物作用降解的主要对象就是侧链结构,这些类脂侧链具有明显的较轻的碳同位素组成,这可以说明δ13C1偏轻的原因;另一方面,同位素形成分配函数比(即β因子)与重同位素的丰度成正比,其值越大,对应结构的同位素组成就越重,而天然的固体有机母质中甲基碳原子β因子(βδ13C)的值明显小于羧基[27]。可见有机母质本身甲基碳同位素组成偏轻,而羧基碳同位素组成偏重。本次生物气产出的方式以乙酸发酵为主,发酵过程中通过甲基加氢而形成CH4,羧基去氢形成CO2,如此煤中甲基组成的轻碳同位素易被分馏到CH4中,而羧基组成的重碳同位素易被分馏到CO2中,生物甲烷越是富集12C,δ13C1越轻,越是会导致CO2富集重碳同位素,δ13C(CO2)变重,其结果就是生物产出气中甲烷总体有富集轻碳同位素的趋势。需要说明的是,在整个产气的过程中,可能存在CO2溶解分馏效应、CH4和CO2的碳同位素交换平衡效应等,但这些不是同位素分馏的主要原因,同位素继承效应才是引起分馏的关键因素。
表4 生气组分中CH4和CO2的碳氢同位素测试结果
Table 4 Results of carbon and hydrogen isotopes of CH4 and CO2 in gas-generating composition‰

生气瓶编号(检测时间点)δD(SMOW)CH4δ13C(PDB)CH4CO2H1-30(30 d)-332-56.6-18.9H1-50(50 d)-353-57.4-20.8H1-70(70 d)-344-67.2-10.7H1-90(90 d)-354-56.9-20.2H3-30(30 d)-337-56.5-18.2H3-50(50 d)-350-56.9-19.1H3-70(70 d)-347-56.5-19.0H3-90(90 d)-356-62.0-18.1CY-30(30 d)-336-57.4-17.1CY-50(50 d)-361-66.4-12.2CY-70(70 d)-350-68.1-11.4CY-90(90 d)-356-69.8-10.8

图3 基于甲烷碳氢同位素组成的产出气成因判识
Fig.3 Identification of genesis of produced gas based on carbon and hydrogen isotope composition of methane

图4 δ13C1,δ13C(CO2)和产气时间3者之间的关系
Fig.4 Relationship among δ13C1,δ13C(CO2) and gas production time
3 结 论
(1)90 d煤制生物气过程中,生物气以乙酸发酵方式产出为主,其组分以CH4和CO2为主,几乎不含重烃气(C2+),气体组成偏干,进入产气稳定期后CH4和CO2含量呈现明显的协同式或同步变化规律。
(2)本次煤制生物气的δ13C1值均小于-55‰,甲烷碳同位素组成偏轻,为有机生物成因气,产出气体同位素组成由于对母质的继承效应使得轻碳同位素被分馏到CH4中,重碳同位素被分馏到CO2中,δ13C1越轻,δ13C(CO2)越重,两者呈现负相关关系,产出气中甲烷有富集轻碳同位素的趋势。
(3)煤制生物气的碳同位素组成存在两次重要的继承性分馏效应,第1次分馏发生在生成乙酸的过程中,乙酸中的甲基碳和羧基碳的同位素组成继承于煤中有机质;第2次分馏发生在乙酸发酵生成CH4和CO2过程中,CH4和CO2的碳同位素组成继承于乙酸,甲基通过加氢形成CH4,羧基通过去氢形成CO2,造成甲基的轻碳同位素被分馏到CH4中,而羧基的重碳同位素被分馏到CO2中。
[1] SONG Y,LIU S,ZHANG Q,et al.Coalbed methane genesis,occurrence and accumulation in China[J].Petroleum Science,2012,9(3):269-280.
[2] 王万春,刘文汇,王国仓,等.沉积有机质微生物降解与生物气源岩识别[J].石油学报,2016,37(3):318-327.
WANG Wanchun,LIU Wenhui,WANG Guocang,et al.Biodegradation of depositional organic matter and identification of biogenic gas source rocks[J].Acta Petrolei Sinica,2016,37(3):318-327.
[3] 徐永昌.天然气成因理论及应用[M].北京:科学出版社,1994.
[4] MICHAEL F,ANNA M,STEVEN P.Biodegradation of sedimentary organic matter associated with coalbed methane in the Powder River and San Juan Basin,USA[J].International Journal of Coal Geology,2008,76(1):86-97.
[5] FAIZ M,HENDRY P.Significance of microbial activity in Australian coal bed methane reservoirs review[J].Bulletin of Canadian Petroleum Geology,2006,54(3):261-272.
[6] SMITH J W,PALLASSER R J.Microbial origin of Australian coalbed methane[J].AAPG Bulletin,1996,80(6):891-897.
[7] KOATARBA M J.Composition and origin of coalbed gases in the Upper Silesian and Lublin basins,Poland[J].Organic Geochemistry,2001,32(1):163-180.
[8] ARAVENA R,HARRISON S M,BARKER J F,et al.Origin of methane in the elk valley coalfield,southeastern british columbia,Canada[J].Chemical Geology,2003,195(1):219-227.
[9] 陶明信,王万春,解光新,等.中国部分煤田发现的次生生物成因煤层气[J].科学通报,2005,50(S1):14-18.
TAO Mingxin,WANG Wanchun,XIE Guangxin,et al.The secondary biogenic coalbed methane discovered in some coal fields in China[J].Science Bulletin,2005,50(S1):14-18.
[10] 王万春,陶明信,张小军,等.李雅庄煤矿煤岩中C25、C30等无环类异戊二烯烷烃的检出及其地球化学意义[J].沉积学报,2006,24(6):897-900.
WANG Wanchun,TAO Mingxin,ZHANG Xiaojun,et al.C25,C30 and other acyclic isoprenoid alkanes in the coal rock of the Li yazhuang coal mine and their geochemical significance[J].Acta Sedimentologica Sinica,2006,24(6):897-900.
[11] TAO Mingxin,SHI Baoguang,LI Jinying,et al.Secondary biological coalbed gas in the Xinji area,Anhui Province,China:Evidence from the geochemical features andsecondary changes[J].International Journal of Coal Geology,2007,71(2):358-370.
[12] TAO Mingxin,LI Jing,LI Xiaobin,et al.New approaches and markers for identifying secondary biogenic coalbed gas[J].Acta Geologica Sinica,2012,86(1):199-208.
[13] 佟莉,琚宜文,杨梅,等.淮北煤田芦岭矿区次生生物气地球化学证据及其生成途径[J].煤炭学报,2013,38(2):288-293.
TONG Li,JU Yiwen,YANG Mei,et al.Geochemical evidence of secondary biogenic and generation approach in Luling Coal Mine of Huaibei coalfield[J].Journal of China Coal Society,2013,38(2):288-293.
[14] BAO Y,JU Y,HUANG H,et al.Potential and constraints of biogenic methane generation from coals and mudstones from Huaibei coalfield,Eastern China[J].Energy & Fuels,2019,33(1):287-295.
[15] DAISUKE M,HANAKO M,HIDEYUKI T,et al.Methane production from coal by a single methanogen[J].Science 2016,305(6309):222-225.
[16] 王爱宽.褐煤本源菌生气特征及其作用机理[D].徐州:中国矿业大学,2010.
WANG Aikuan.Gas generation characteristics and mechanism of action of indigenous bacteria on lignite[D].Xuzhou:China University of Mining and Technology,2010.
[17] 王爱宽,秦勇,林玉成,等.褐煤中天然产甲烷菌富集培养与生物气产出模拟[J].高校地质学报,2010,16(1):80-85.
WANG Aikuan,QIN Yong,LIN Yucheng,et al.Enrichment and cultivation of natural methanogen and simulation of biogenetic gas generation from brown coal samples[J].Geological Journal of China Universities,2010,16(1):80-85.
[18] WOLTMATE I,WHITICAR M J,SCHOELL M.Carbon and hydrogen isotopic composition of bacterial methane in a shallow freshwater lake[J].Limnol Oceanogr,1984,29(5):985-992.
[19] WHITICAR M J,FABER E,SCHOELL M.Biogenic methane formation in marine and freshwater environments:CO2 reduction vs.acetate fermentation-Isotopic evidence[J].Geochimica et Cosmochimica Acta,1986,50(5):693-709.
[20] 陶明信,王万春,李中平,等.煤层中次生生物气的形成途径与母质综合研究[J].科学通报,2014,59(11):970-978.
TAO Mingxin,WANG Wanchun,LI Zhongping,et al.Comprehensive study on the formation pathway and parent material of secondary biogas in coalbed[J].Science Bulletin,2014,59(11):970-978.
[21] 夏大平,兰建义,陈曦,等.微量元素在煤层生物甲烷形成时激励与阻滞体系研究[J].煤炭学报,2017,42(5):1230-1235.
XIA Daping,LAN Jianyi,CHEN Xi,et al.Study on the excitation and blocking system of trace elements in coals on the production of biogenic methane[J].Journal of China Coal Society,2017,42(5):1230-1235.
[22] 邵培,王爱宽,王文峰.中低煤阶煤的生物气生成特征[J].煤炭科学技术,2016,44(10):65-69.
SHAO Pei,WANG Aikuan,WANG Wenfeng.Biogas formation features of low and medium rank coal[J].Coal Science and Technology,2016,44(10):65-69.
[23] 张攀攀,郭红光,段凯鑫,等.无烟煤厌氧代谢产物对其纳米孔隙的影响[J].煤炭学报:1-12[2020-07-03].https://doi.org/10.13225/j.cnki.jccs.2019.1263.
ZHANG Panpan,GUO Hongguang,DUAN Kaixin,et al.Effects of microbial anaerobic metabolites on nanoporosity of anthracite[J].Journal of China Coal Society:1-12[2020-07-03].https://doi.org/10.13225/j.cnki.jccs.2019.1263.
[24] 赵娜,韩作颖.微生物降解褐煤产气实验研究[J].煤炭转化,2019,42(3):49-54.
ZHAO Na,HAN Zuoying.Experimental study on microbial degradation of lignite for gas production[J].Coal Conversion,2019,42(3):49-54.
[25] JIAN Kuo,CHEN Gang,GUO Chen,et al.Biogenic gas simulation of low-rank coal and its structure evolution[J].Journal of Petroleum Science and Engineering,2019,173:1284-1288.
[26] 戴金星,陈英.中国生物气中烷烃组分的碳同位素特征及其鉴别标志[J].中国科学(D),1993,23(3):303-310.
DAI Jinxing,CHEN Ying.Carbon isotopic characteristics and identification criteria of alkanes in biogas from China[J].Chinese Science(D),1993,23(3):303-310.
[27] GALIMOV E M.The Biological Fractionation of Isotopes[M].Orlando:Academic Press,1981:113-116.
[28] JAMES A T.Correlation of reservoired gases using the carbon isotopic compositions of wet gas components[J].AAPG Bulletin,1990,74(9):1441-1458.
[29] 刘文汇,于心科,张柏生.沉积有机质芳核与侧链碳同位素组成分布特征[J].科学通报,1995,40(20):145-147.
LIU Wenhui,YU Xinke,ZHANG Baisheng.Distribution characteristics of core and side chain carbon isotope composition of sedimentary organic matter[J].Science Bulletin,1995,40(20):145-147.
