煤气化技术是煤炭清洁高效利用的核心技术,也是现代煤化工的基础[1]。通过将煤在高温下气化制得合成气,继而以合成气为原料合成化学品、液体燃料,进行直接还原炼铁等[2]。合成气最主要的成分包括H2,CO,CO2和水蒸气,由于这4种气体的存在,使得水煤气变换反应(H2O+CO![]() CO2+H2)成为气化过程中必然存在的一环。
CO2+H2)成为气化过程中必然存在的一环。
水煤气变换反应是可逆的气相反应,对于合成气中主要成分的比例可能有显著影响,因此对煤气化过程的研究,尤其在整个反应过程的计算机模拟研究中是不可忽略的一个部分。在一些煤气化流程模拟中,会考虑水煤气变换反应对出口合成气组分的影响,但对于反应程度只是根据反应条件做定性判断或简化处理[3],DAI等则将水煤气变换反应作为一个单独的模块进行计算[4]。在对气化过程中的水煤气变换反应进行动力学模拟计算时,通常将其作为一个独立的均相反应进行计算[5],此反应的速率系数通常用一个只与气体温度有关的方程来计算[6]。由于水煤气变换反应对调节合成气中各组分比例有重要意义,因此对于此反应的机理及动力学的研究由来已久[7-10],相关催化剂也有广泛研究[11-12],后人根据这些研究建立的动力学模型及相应的模型参数进行模拟计算。然而实际的煤气化工艺中反应环境较为复杂,除了水煤气变换反应的本征动力学外,其他因素也可能对此反应进行程度有一定影响。周晨亮等[13]研究认为,煤中的矿物质会对水煤气变换反应产生影响。
目前水煤气变换反应的研究,主要是针对在600 ℃以下进行的正向催化反应[14-18] ,而反应温度在600 ℃以上及非催化条件下的研究报道相对较少。笔者针对煤气化工艺中的实际反应条件,研究了较短停留时间较高温度下水煤气变换反应程度,考察了煤灰和不同粒径煤焦的存在对此反应的影响。
1 实验部分
1.1 实验原料
使用H2,CO,CO2和N2钢瓶气,参考工业水煤浆气化炉出口合成气组成,配成不同组成的原料气。使用恒流蠕动泵与加热罐生成水蒸气,并通过N2带出形成水蒸气流,N2流量为300 mL/min。不同组成的原料气各气体含量见表1。1~3号原料气为不同比例的气化合成气,4~6号原料气为前3种原料气去除水蒸气的干燥组分。7号原料气为只有正向反应物(CO,H2O)的组分,8号原料气则为只有逆向变换反应物(CO2,H2)的组分。
表1 原料气组成
Table 1 Composition of raw gas

原料气序号气体流量/(mL·min-1),气体体积分数/%CO2COH2H2O(g)1300,131 020,44680,30300,132400,17960,40640,27400,173500,20900,36600,24500,204300,151 020,51680,340,05400,20960,48640,320,06500,25900,45600,300,070,0960,710,0400,298400,380,0640,620,0
实验用到的煤灰与煤焦均来自一种内蒙古褐煤,煤灰为粒径<0.2 mm的原煤粉末按照GB/T 212—2008方法缓慢灰化所得,煤焦为原煤在N2气氛中1 100 ℃慢速热解所得。煤灰组成的XRF分析、煤焦工业分析及元素分析见表2,3。
1.2 实验装置
实验在一个带有可控温电加热设备的小型固定床管式反应器中进行,如图1所示。使用高纯刚玉管(外径40 mm,内径约32 mm,长1 100 mm)作为反应管,其中部恒温区长约为400 mm,实验条件下气体停留时间约为1~2 s。中部可垂直放置一个刚玉填料器,填料器底部填充耐火棉以托住所用介质颗粒。填料器下端使用刚玉管支撑,使得其位于恒温区中。反应器在N2气氛中匀速升温至所需温度并保持恒温,之后切换成混合均匀的原料气通入反应器进行实验。反应在常压下进行,使用红外气体分析仪及气相色谱对出口气体进行分析。
表2 内蒙古褐煤灰成分分析
Table 2 Inner Mongolia lignite ash analysis

成分SiO2Al2O3CaOSO3Fe2O3MgOK2ONa2O质量分数/%61.2317.427.092.736.802.310.800.73
表3 煤焦元素分析和工业分析
Table 3 Proximate analysis and ultimate analysis of coal char samples %

元素分析NadCadHadSad工业分析MadVadFCadAad1.1274.120.060.450.964.2072.4322.42

图1 管式炉实验流程
Fig.1 Schematic diagram of tube furnace setup
1.3 数据处理方法
变换反应进行程度用CO转化率(x1)和CO2转化率(x2)两个参数衡量。正向变换反应,x1为正值,x2为负值,逆向变换反应则相反。一般正向反应程度用x1衡量,逆向反应用x2衡量。由于变换反应中CO和CO2气体之间相互转化,这两种气体总体积在反应前后不发生变化,因此通过测得某实验条件下出口各气体组分的体积分数,计算其转化率:

整理可得
同理可得
式中,yin,1和yin,2分别为原料气中CO和CO2的体积分数;yout,1和yout,2分别为测得出口气体中CO和CO2的体积分数。
2 结果与讨论
2.1 空白实验
将1~3号原料气通入炉内,分别测得700,900,1 100,1 300 ℃下组成变化,计算出CO转化率。利用ASPEN PLUS软件可以方便计算出相同条件下反应达平衡时组分含量,以此计算出相应反应的CO 转化率,结果如图2所示。

图2 不同工况下CO转化率与对应平衡CO转化率
Fig.2 Experimental CO conversion and equilibrium CO conversion in different conditions
从图2可以看出合成气在1 100 ℃以下,反应速率较慢,在实验条件所限的停留时间内CO转化率接近于0,几乎没有反应。当温度达到1 300 ℃时,有明显的逆向变换反应发生,但是反应程度与反应平衡仍有一定距离。3种不同进气组成对反应规律并无明显影响,不同组成各温度反应程度与反应平衡的关系基本一致。
将4~6号原料气通入炉内,分别测得不同温度下组成变化,计算出CO2转化率。同样计算出相应反应平衡时CO2 转化率,结果如图3所示。

图3 不同工况下CO2转化率与对应平衡CO2转化率
Fig.3 Experimental CO2 conversion and equilibrium CO2 conversion in different conditions
从图3可以看出在无水蒸气的实验条件下,温度在900 ℃以下CO2转化率接近于0,基本不发生反应。当温度升至1 100 ℃时,发生了明显的逆变换反应。各种不同组成进气的CO2转化率实验值均为反应平衡时CO2转化率的35%~40%,反应程度基本一致。1 300 ℃时,不同组成原料气的CO2转化率与反应平衡时CO2转化率接近,可以认为反应在该温度下已基本达到平衡状态。
将7,8号原料气通入炉内,考察仅有单向反应原料时的反应程度,结果如图4所示。从图4可以看出,即使没有反应产物对反应的抑制作用,在700,900 ℃时,无论正向反应还是逆变换反应,反应程度都非常微弱。1 100 ℃时,正逆向变换反应程度显著提升,CO,CO2转化率分别达到对应反应平衡转化率的60%以上。1 300 ℃时,正逆向变换反应CO或CO2转化率与对应反应平衡转化率接近,反应基本达到平衡状态。

图4 不同温度下CO与CO2转化率与反应平衡转化率
Fig.4 Experimental CO and CO2 conversion and equilibrium CO or CO2 conversion in different temperature
综合以上结果可以发现,700,900 ℃时正逆向变换反应较为缓慢,在较短停留时间内反应程度较为微弱。1 100 ℃时在实验条件下单向反应有较高的转化率。然而,以合成气为原料时,由于反应产物的抑制作用,所以在实验条件下反应程度非常微弱。无水蒸气的合成气能够进行一定程度的逆变换反应,对比单向逆变换反应可以看出,受到CO存在的影响,其逆变换反应程度也受到一定地抑制。1 300 ℃时,正逆向单向反应可基本达到反应平衡,然而对于合成气,由于受到各组分之间的相互影响,反应程度与反应平衡仍有一定差距。尽管去除水蒸气之后,气体组成与平衡组成差异更大,但其逆变换反应程度基本达到反应平衡,说明高水蒸气含量对于降低逆变换反应速率作用显著。

图5 不同温度不同介质CO或CO2转化率
Fig.5 CO and CO2 conversion in different conditions and temperature
2.2 煤灰对变换反应的影响
煤灰中含有多种矿物质和金属氧化物,对水煤气变换反应可能会有一定影响。铁系催化剂是一种较为常见的水煤气高温变换反应催化剂[19],煤灰的几种主要组成物质中,铁氧化物可能会对水煤气变换反应产生影响,因此将煤灰作为反应介质,考察其对水煤气变换反应的影响。在炉内恒温区中心放入6 g煤灰作为反应介质,介质高度约为8 cm,由于所用煤灰在1 300 ℃时已经熔融,因此实验温度为700~1 100 ℃。通入2,5号原料气,考察不同温度下的反应程度,结果如图5所示。从图5可以看出,煤灰的加入对反应趋势和方向没有影响,对不同温度不同原料气的反应均有促进作用。无论反应是正向还是逆向,反应物的转化率均在原方向上有所提高。
在700和900 ℃时,2号原料气在空白实验中基本检测不到水煤气变换反应的发生,而加入煤灰介质后,都出现了较为明显的反应,CO转化率分别提高了约0.8%,0.9%。在1 100 ℃时反应程度的增加幅度更大,CO转化率提高了约2.3%。对于无水蒸气而只发生逆变换反应的5号原料气,在700 ℃时通过煤灰介质层仍检测不到反应的发生。在900,1 100 ℃时,通过煤灰介质层反应程度均有所增加,且增幅随着温度升高而增大,CO2转化率分别提高了约0.9%,2.4%。煤灰中对于水煤气变换反应有催化作用的物质主要是铁氧化物,铁氧化物在煤灰中的含量并不高,而且实验温度远高于一般铁基变换催化剂的活性温度(350~500 ℃)[20],因此催化效果会有所下降。铁基催化剂高温失活的主要原因是烧结导致比表面积下降[21]。实验中发现煤灰在高温下有一定程度的烧结现象,尤其是1 100 ℃比较明显,这在一定程度上会影响其作用效果。研究表明,一些非催化活性成分对于反应物质的吸附作用,对于变换反应也有一定帮助[22]。煤灰可以提供一定的表面积和孔隙结构。尽管煤灰的表面积不高,孔隙结构并不发达,但相对于完全空白的反应环境,仍可能对变换反应起到一定的促进作用。由于以上原因,煤灰作为介质不能大幅度提高水煤气变换反应速率,但仍然表现出一定程度的促进作用。
2.3 煤焦对变换反应的影响
在气化过程中,原煤在高温下会迅速发生热解反应,煤的结构和官能团会发生变化[23]形成煤焦,因而考察煤焦对变换反应的影响。使用原煤在1 100 ℃氮气气氛下慢速热解制得的热解焦作为实验所需反应介质,在炉内恒温区中心分别放入8 g不同粒径原煤热解成焦,介质高度约为8 cm。经过实验测定,700 ℃时水蒸气和CO2不与本实验所用煤焦发生气化反应,因此考察该温度下煤焦介质对变换反应程度的影响。将7,8号原料气通入炉内,考察仅有单向反应原料时的反应程度,实验结果如图6所示。

图6 不同粒径煤焦作为介质时CO或CO2转化率
Fig.6 CO or CO2 conversion with different particle size coal char
从图6可以看出,在实验条件下,随着煤焦介质粒径的增大,正逆向反应程度均有增加趋势,其中以煤焦粒径从0.2~0.4 mm增大至0.8~1.5 mm时尤为明显。当煤焦粒径从0.8~1.5 mm继续增大粒径至5~10 mm时,正逆向反应程度并没有进一步增加。说明在一定范围内,增大介质粒径对促进变换反应的发生有利。当介质粒径增大到一定程度后,继续增大介质粒径将不能继续提高反应程度,甚至会降低促进效果。煤焦颗粒粒径小,有利于气固两相充分接触,从而促进变换反应的进行。然而,当颗粒粒径小到一定程度时,床层阻力会上升,较轻的颗粒也容易被气流驱赶而偏离,导致偏流或沟流的形成,从而降低气体与煤焦的接触效果,不利于煤焦发挥作用。因此过小粒径的煤焦对气相反应的作用效果受到限制。煤焦颗粒有一定的大小和质量有利于其均匀稳定的分布,获得与气体良好的接触效果,从而更有效的促进气相反应发生。当颗粒粒径继续增大,虽然分布均匀,但比表面积会逐渐降低,可以与气体接触的部分减少,作用效果减弱。因此煤焦颗粒粒径增大到一定程度,其对气相反应的促进效果不再增加,甚至有所降低。
在700 ℃条件下通入2号原料气,考察不同粒径热解焦对水煤气变换反应的影响,并与煤灰介质和空白实验作对比,结果如图7(a)所示。从图7(a)可以看出,与空白条件相比,煤焦作为介质有利于促进变换反应的发生。以粒径0.2 mm以下的煤焦作为介质时,CO转化率从空白实验的0.2%提高到1.0%。随着煤焦粒径增大,反应程度加深。加入粒径为0.8~1.5 mm的煤焦时反应程度最高,CO转化率达到1.9%。但当介质粒径增大到5~10 mm时,反应程度比0.8~1.5 mm时有小幅下降,CO转化率为1.5%,说明增大粒径仅在一定范围内有利于反应,此规律与单向反应一致。实验所用煤灰是粒径为0.2 mm以下的煤烧灰所得,其粒径与0.2 mm以下的煤焦介质相近。而根据实验结果可以发现,煤灰介质与粒径为0.2 mm以下的煤焦介质对反应促进效果非常接近。
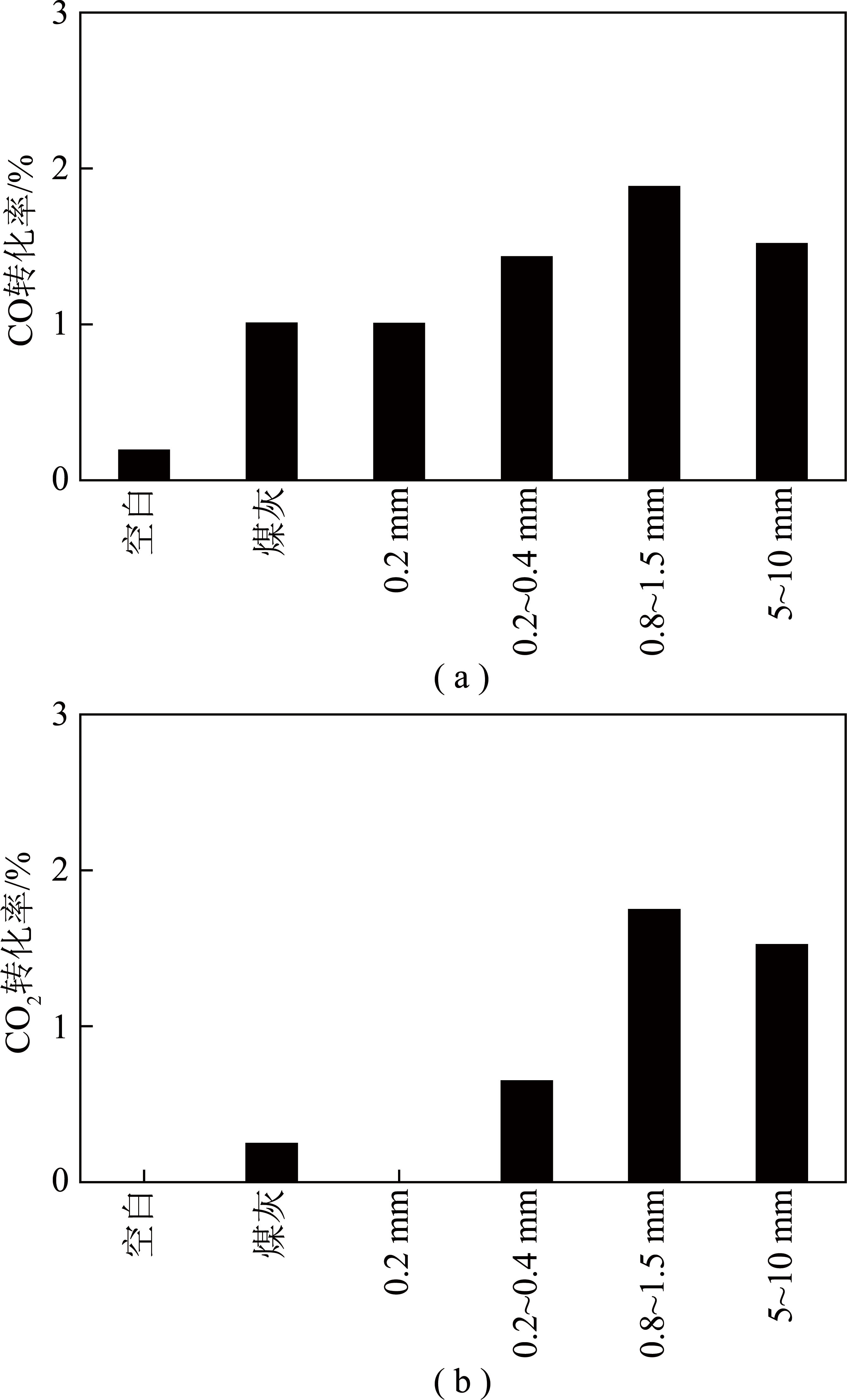
图7 不同介质时CO,CO2转化率
Fig.7 CO and CO2 conversion with different reaction medium
在700 ℃条件下通入5号原料气,考察不同粒径热解焦对干燥合成气变换反应的影响,并与煤灰介质和空白实验作对比,结果如图7(b)所示。不添加水蒸气的合成气只能进行逆向变换反应,根据空白实验结果,此原料气900 ℃以下检测不到反应发生。而以煤灰作为介质时,反应非常微弱,CO2转化率仅有0.2%。以0.2 mm以下粒径煤焦为介质时,仍然检测不到反应发生。以0.2~0.4 mm粒径煤焦为介质时,在实验条件下CO2转化率为0.6%,反应速率较前3种情况有所提升,但CO2转化率仍较低。以0.8~1.5 mm和5~10 mm粒径煤焦为介质时,反应程度有了较为明显的提高,CO2转化率分别达到1.7%和1.5%。干燥合成气的变换反应受到不同粒径煤焦介质影响的规律与含蒸汽合成气基本一致。
根据工业分析的结果,煤焦中灰含量为24.88%,剩余部分基本都是固定碳,所以煤焦中可能有催化活性的金属化合物含量要比煤灰低得多。然而,相近粒径的煤焦颗粒与煤灰颗粒对于水煤气变换反应的促进效果是较为接近的,这反映出金属氧化物对变换反应的促进作用是比较有限的。由于实验温度远远高于一般水煤气变换反应催化剂的活性温度,在此条件下金属氧化物的催化活性可能较低。相比于催化剂,无论是煤灰还是煤焦,都没有非常丰富的孔隙结构和很高的比表面积,且金属氧化物的分散性和气固接触效果都不利于介质中所含的金属氧化物发挥作用,活性成分的催化效果受到很大限制。因此在实验条件下,金属氧化物含量相对较高的煤灰在对水煤气变换反应的促进作用上并不能明显高于煤焦。相比较而言,粒径的差异对于变换反应的影响要更为明显,粒径小于0.4 mm 时介质的作用效果显著降低,过小的粒径可能会使得气固相接触不佳,从而对介质发挥作用产生了较为显著的不利影响。由此可见,煤灰和煤焦提供的表面积以及对反应气体的吸附作用是促进变换反应的主要原因,而铁等有催化活性的金属含量对于反应影响相对较小。
3 结 论
(1)在较短的停留时间内,气化合成气水煤气变换反应在较低温度下的正向反应,由于反应速率过慢使得反应程度接近于0,而高温下能够发生一定程度的逆变换反应,但不易达到反应平衡。干燥合成气在高温下的逆变换反应则容易达到反应平衡。
(2)煤灰对正逆向水煤气变换反应均有一定的促进作用,其只加快反应速率而不影响反应方向。尽管高温下煤灰有一定程度的烧结现象,但随着温度升高,煤灰对反应的促进作用仍有一定加强。在实验条件下,相比于空白实验,加入煤灰介质后,合成气CO转化率在700,900,1 100 ℃时分别增加了0.8%,0.9%,2.3%。而干燥合成气在700 ℃时仍检测不到反应的发生,在900,1 100 ℃时,CO2转化率分别提高了0.9%,2.4%。煤灰对气体的吸附作用以及灰中的铁等金属元素的催化作用可能是促进变换反应进行的原因,然而气固接触不良和不发达的孔隙结构使得这种促进作用效果较为有限。
(3)煤焦对水煤气变换反应有着与煤灰相似的促进作用。粒径不同对于煤焦的促进作用大小有着较为明显的影响。粒径过大,表面积下降,气固接触不充分,促进作用降低。粒径过小可能导致气相分布不均,严重影响气固接触,致使固相介质的促进作用显著下降。实验条件下,粒径为0.8~1.5 mm的煤焦对反应的促进作用最明显,相对于空白实验,合成气CO转化率以及干燥合成气CO2转化率均提高了1.7%。相比于金属氧化物含量对水煤气变化反应的影响,粒径的影响更为显著。
[1] 王辅臣,于遵宏.煤炭气化技术[M].北京:化学工业出版社,2010.
[2] 王辅臣,于广锁,龚欣,等.大型煤气化技术的研究与发展[J].化工进展,2009,28(2):173-180.
WANG Fuchen,YU Guangsuo,GONG Xin,et al.Research and development of large-scale coal gasification technology[J].Chemical Industry and Engineering Progress,2009,28(2):173-180.
[3] 张磊,汪根宝,谢东升,等.GE水煤浆气化全流程模拟[J].化学工程,2011,39(7):78-82.
ZHANG Lei,WANG Genbao,XIE Dongsheng,et al.Simulation of whole GE water-coal slurry gasification process[J].Chemical Engineering,2011,39(7):78-82.
[4] DAI B,ZHANG L,CUI J F,et al.Integration of pyrolysis and entrained-bed gasification for the production of chemicals from victorian brown coal-process simulation and exergy analysis[J].Fuel Processing Technology,2017,155:21-31.
[5] WANG Y,JIN W,ZHU L,et al.Simulation research on the fixed-bed gasification process in a two-stage combined gasifier[J].Industrial & Engineering Chemistry Research,2014,53(18):7611-7621.
[6] COLOMBA D B.Modeling wood gasification in a countercurrent fixed-bed reactor[J].AIChE Journal,2004,50(9):2306-2319.
[7] GRAVEN W M,LONG F J.Kinetics and mechanisms of the two opposing reactions of the equilibrium CO+H2O=CO2+H2[J].Journal of the American Chemical Society,1954,76(10):2602-2607.
[8] BUSTAMANTE F,ENICK R M,CUGINI A V,et al.High-temperature kinetics of the homogeneous reverse water-gas shift reaction[J].AIChE Journal,2004,50(50):1028-1041.
[9] HOLGATE H R,TESTER J W.Oxidation of hydrogen and carbon monoxide in sub-and supercritical water:Reaction kinetics,pathways,and water-density effects.2.Elementary reaction modeling[J].Journal of Physical Chemistry,1994,98(3):810-822.
[10] BUSTAMANTE F,ENICK R M,KILLMEYER R P,et al.Uncatalyzed and wall-catalyzed forward water-gas shift reaction kinetics[J].AIChE Journal,2005,51(5):1440-1454.
[11] KO J B,BAE C M,JUNG Y S,et al.Cu-ZrO2 Catalysts for water-gas-shift reaction at low temperatures[J].Catalysis Letters,2005,105(3-4):157-161.
[12] YAN H,QIN X T,YIN Y,et al.Promoted Cu-Fe3O4 catalysts for low-temperature water gas shift reaction:Optimization of Cu content[J].Applied Catalysis B:Environmental,2018,226:182-193.
[13] 周晨亮,刘全生,李阳,等.胜利褐煤水蒸气气化制富氢合成气及其固有矿物质的催化作用[J].化工学报,2013,64(6):2092-2102.
ZHOU Chenliang,LIU Quansheng,LI Yang,et al.Production of hydrogen-rich syngas by steam gasification of Shengli lignite and catalytic effect of inherent minerals[J].CIESC Journal,2013,64(6):2092-2102.
[14] SALMI T,HAKKARAINEN R.Kinetic Study of the low-temperature water-gas shift reaction over a Cu-ZnO catalyst[J].Applied Catalysis,1989,49(2):285-306.
[15] KEISKI R L,DESPONDS O,CHANG Y F,et al.Kinetics of the water-gas shift reaction over several alkane activation and water-gas shift catalysts[J].Applied Catalysis A:General,1993,101(2):317-338.
[16] RHODES C,HUTCHINGS G J,WARD A M.Water-gas shift reaction:Finding the mechanistic boundary[J].Catalysis Today,1995,23(1):43-58.
[17] BUNLUESIN T,GORTE R J,GRAHAM G W.Studies of the water-gas-shift reaction on ceria-supported Pt,Pd,and Rh:Implications for oxygen-storage properties[J].Applied Catalysis B Environmental,1998,15(1-2):107-114.
[18] LI Y,FU Q,MARIA FS.Low-temperature water-gas shift reaction over Cu-and Ni-loaded cerium oxide catalysts[J].Applied Catalysis B:Environmental,2000,27(3):179-191.
[19] GRADISHER L,DUTCHER B,FAN M.Catalytic hydrogen production from fossil fuels via the water gas shift reaction[J].Applied Energy,2015,139(12):335-349.
[20] 徐静.煤制SNG中CO变换过程的研究进展[J].当代化工,2014,43(3):373-375.
XU Jing.Research progress in CO shift process in producing SNG from coal[J].Contemporary Chemical Industry,2014,43(3):373-375.
[21] 刘全生,张前程,马文平,等.变换催化剂研究进展[J].化学进展,2005,17(3):389-398.
LIU Quansheng,ZHANG Qiancheng,MA Wenping,et al.Progress in water-gas-shift catalysts[J].Process in Chemistry,2005,17(3):389-398.
[22] LENARDA M,KASPAR J,GANZERLA R,et al.Water gas shift reaction catalyzed by osmium carbonyls supported on zeolites[J].Journal of Catalysis,1988,112(1):1-11.
[23] ZHANG L,QI S,TAKEDA N,et al.Characteristics of gas evolution profiles during coal pyrolysis and its relation with the variation of functional groups[J].International Journal of Coal Science & Technology,2018,5(4):452-463.
