在复杂的地球化学、水岩作用及人类环境破坏影响下,中国、印度、非洲、拉美、欧洲、美国、中东等许多国家和地区同时存在地下水氟、铁、锰超标问题[1-2]。我国的东北地区、陕西、内蒙古中北部及山东西北部地区等以地下水为饮用水源的诸多矿区和农村超过1亿人受氟、铁、锰同时超标的危害[3-4]。氟、铁、锰均是人体必需的微量元素,但过量的氟在人体中蓄积易引发氟骨病并破坏人体泌尿及内分泌系统,过量的铁在人体中积累会损伤脏器,过量的锰会影响人体的中枢神经系统和呼吸系统[5-7]。若长期以高氟高铁锰地下水为饮用水供水水源,将会严重影响人的身体健康,对人体造成不可逆转的伤害[8]。
国内外对单独除氟和去铁锰的研究较多[9-11],然而,3种离子共存时同步去除研究较少,有必要将地下水除氟和去铁锰结合起来处理[12]。相比地下水中其他污染物处理方法,吸附法具有成本低、环境友好的优点,成为除氟去铁锰的热点,而如何选取或制备同步除氟去铁锰的吸附材料是研究和应用的关键[13-14]。研究表明,天然或合成的羟基磷灰石(HAP)含有独特的晶系结构,具有高吸附能力、低价格、低水溶性和氧化还原条件下的高稳定性,是处理含氟和重金属水体的最有前途的矿物材料[15]。但HAP存在增加水浊度、易团聚的问题[16]。近年来,国内外大量学者开展了对HAP改性及负载的研究,并在污染治理应用中进行了积极的探索[17]。SUNDARAM等[18]制备了纳米羟基磷灰石/壳聚糖(n-HAPC)复合材料,其脱氟能力比天然HAP提升了17%;张连科等[19]将纳米羟基磷灰石(nHAP)负载在玉米秸秆制备的生物炭(BC)上,形成nHAP/BC复合材料,不仅实现了玉米秸秆的废弃资源利用,而且有效分散了nHAP颗粒,实现了对工业废水中铅离子的良好吸附。蛇纹石(Srp)价格低廉、吸附性能强,内部细密的纤维状结构使其成为一种优良的载体,除对氟离子有较强吸附性外,热活化后的活性基团还可吸附金属离子[20-21]。
基于此,笔者充分运用Srp和HAP各自优势,在前期研究基础上,制备了一种成本低廉、吸附效果好的Srp/HAP新型复合吸附材料,通过室内动态试验,研究了复合颗粒对F-,Fe2+,Mn2+同步吸附效果,以期为Srp/HAP复合吸附剂在地下水源饮用水处理和矿区地下水污染修复方面的应用提供参考。
根据前期13个地下水监测井近5 a监测结果显示,阜新矿区F-质量浓度一般在1.5~5.0 mg/L,Fe2+质量浓度多在3.5~15.5 mg/L,个别超过20 mg/L,Mn2+质量浓度为0.9~4.8 mg/L,pH为6.2~7.0。《生活饮用水卫生标准(GB5749—2006)》中氟、铁、锰质量浓度限值分别为1.0,0.3和0.1 mg/L,可见,阜新矿区地下水质属于典型的高氟高铁锰地下水。考虑实际地下水的波动性和复杂性,模拟阜新矿区地下水质配置实验水样。水样F-,Fe2+,Mn2+质量浓度分别为5,20和5 mg/L,调节pH为6.5。F-采用PF-2-01型氟离子选择电极测定,Fe2+,Mn2+采用Z-2000 型原子吸收分光光度计测定,pH值用PHS-3C型精密pH计测定。
蛇纹石取自辽宁省营口市大石桥后仙峪硼矿区。蛇纹石负载羟基磷灰石采用湿法化学共沉淀法制备:按固液比为20%将蛇纹石(120目)均匀分散在硝酸钙溶液(0.5 mol/L)中,搅拌6 h后将1 mol/L磷酸溶液(控制Ca/P物质的量比为1.67)缓慢滴入其中,搅拌至溶液形成凝胶状物质,陈化20 h(为了蛇纹石有效释放碱度以减少氨水用量)后滴加氨水调节pH至11,再陈化24 h,抽滤后滤饼在烘箱中90 ℃烘干72 h成干凝胶,再在400 ℃马弗炉中煅烧60 min后研磨过120目筛,加入80 ℃、2%糊化的醚化淀粉制成3~5 mm颗粒,经180 ℃下煅烧90 min后制备成复合颗粒吸附剂。
SEM采用日本电子JSM-7 500F型扫描电子显微镜,材料表面形态变化、粒径和团聚情况分析;EDS采用FYFS-2002E型能谱仪,材料的元素及含量分析;XRD采用岛津XRD-6100型X射线衍射仪,样品物相分析;BET采用康塔Atuosorb-iQ型比表面与孔隙度分析仪,N2吸附-脱附法测试吸附材料比表面积与孔径;FT-IR采用IRPrestige-21傅里叶变换红外光谱仪,吸附材料分子结构、化学键及官能团变化表征。
实验在恒温恒湿实验室内开展,室内温度(20±1) ℃,相对湿度50%±3%。实验时,首先在内径5 cm、长50 cm的3个玻璃柱内放置一定高度的复合颗粒,并在柱的上端和下端分别添加5 cm白色砾石和2 cm过滤棉作为保护层。装置进出水方式为下进上出,利用BT50S型蠕动泵进行水样提升,通过LZB-6型玻璃转子流量计进行流量控制。为了使Fe2+不被氧化,可采用吸附柱充入液氮或去离子水排除空气法[22]。本实验采用去离子水排除空气法,实验前用蠕动泵由下至上缓慢注入去离子水排除柱中空气,实验过程中,水样充满复合吸附剂空隙,保持砾石层上3 cm液面高度,并按照设置好的取样时间在取样口定期取样,测定原水及出水F-,Fe2+,Mn2+质量浓度,研究不同柱高、进水流速及进水质量浓度对吸附过程的影响。柱高、进水流速依据前期单因素实验确定的吸附剂最佳投加量、反应时间和柱长、柱径等因素综合确定,梯度结合实际工程在中间值两侧适度外延获得;进水浓度考虑阜新矿区实际,最大值参考国内高氟高铁锰地区水质最大质量浓度确定[23]。吸附试验装置如图1所示。

图1 动态吸附装置示意
Fig.1 Schematic diagram of dynamic adsorption device
穿透曲线以污染物出水质量浓度Ct与进水质量浓度C0之比随运行时间t变化绘制。污染物出水质量浓度为进水质量浓度的5%(Ct/C0=0.05)设定为穿透点,污染物出水质量浓度为进水质量浓度的95%(Ct/C0=0.95)设定为耗竭点,2者对应时间分别为穿透时间(tb)和耗竭时间(te)。按式(1)计算动态柱吸附的离子总量(qtotal),按式(2)计算吸附容量 qe[24]为
![]()
(1)
![]()
(2)
式中,Q为进水体积流速,mL/min;m为复合吸附剂质量,g。
选取Adams-Bohart模型和Thomas模型来模拟Srp/HAP复合颗粒对F-,Fe2+,Mn2+的动态吸附过程[25]。
Adams-Bohart模型是ADAMS和BOHART在1920年基于表面反应理论建立的,模型假定平衡不是瞬时的。该模型经常用于描述穿透曲线初始部分的实验数据,重点是传质速率常数kAB和离子吸附饱和质量浓度N0等特征参数的评估。其方程表达式为
![]()
(3)
式中,kAB为Adams-Bohart传质速率常数,L/(mg·min);N0为离子吸附饱和质量浓度,mg/L;H为吸附柱高度,cm;W为溶液流动速率,cm/min。
Thomas模型被广泛用于分析在不同床深、流速和初始质量浓度下床柱的吸附性能,模型假定吸附过程遵循Langmuir吸附-解吸动力学,没有轴向扩散。其方程表达式:
![]()
(4)
式中,kTh为托马斯传质速率常数,mL/(min·mg);q0为吸附剂最大吸附容量,mg/g;m1为动态柱内装填复合吸附剂的质量,g。
2.1.1 吸附柱高度对穿透曲线的影响
图2显示了进水初始质量浓度分别为5,20和5 mg/L的F-,Fe2+,Mn2+在流速4.0 mL/min,吸附柱高度9 cm(150 g),15 cm(250 g)和21 cm(350 g)时的吸附穿透曲线。吸附传质参数见表1。

图2 不同吸附柱高度时的穿透曲线
Fig.2 Breakthrough curves at different filler bed height
表1 不同吸附柱高度时Srp/HAP 的吸附参数
Table 1 Adsorption parameters of Srp/HAP at different filler bed height
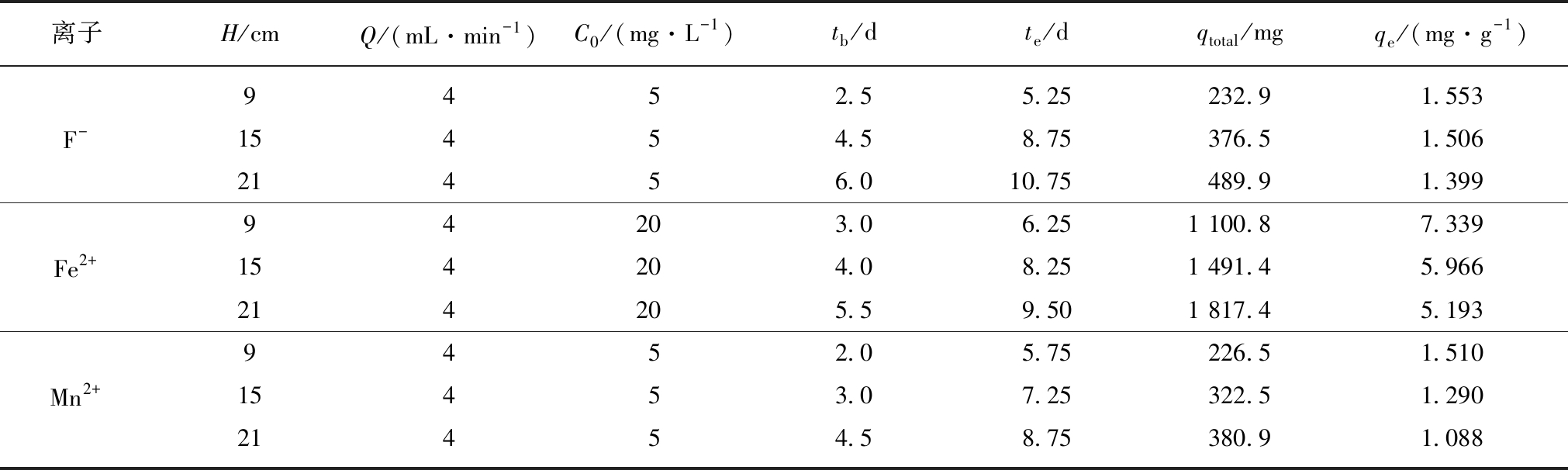
离子H/cmQ/(mL·min-1)C0/(mg·L-1)tb/dte/dqtotal/mgqe/(mg·g-1)9452.55.25232.91.553F-15454.58.75376.51.50621456.010.75489.91.39994203.06.251 100.87.339Fe2+154204.08.251 491.45.966214205.59.501 817.45.1939452.05.75226.51.510Mn2+15453.07.25322.51.29021454.58.75380.91.088
由图2可以看出,随着运行时间的增加,动态柱出水F-,Fe2+,Mn2+质量浓度均逐渐增大,直至达到动态平衡;随着吸附剂填充高度(质量)的增加,各离子穿透曲线均从左向右移动,同一离子穿透点和耗竭点依次滞后,吸附平衡时间依次延长。由表1可知,动态柱处理试验水样中离子的吸附传质区高度(或吸附剂填充质量)与复合吸附剂吸附总量正相关。这是由于,吸附剂填充质量较少时,与试验水样接触时间较短,动态柱提前达到出水耗竭点,随着吸附剂填充高度增加,吸附剂的比表面积增大,表面活性位点增多,使得各离子到达穿透点和耗竭点的时间延长,吸附总量增加[26]。吸附传质区高度(或吸附剂填充质量)与复合吸附剂饱和吸附容量负相关。这是因为水样流过复合吸附剂表面时,常常未达饱和吸附量就已流走,吸附柱越高,未达饱和部分越大,因此会出现动态吸附容量随吸附柱高度增加而降低的现象。
2.1.2 进水流速对穿透曲线的影响
图3显示了进水初始质量浓度分别为5,20和5 mg/L的F-,Fe2+,Mn2+在进水流速分别为2,4和6 mL/min,吸附柱高度15 cm时的吸附穿透曲线。吸附传质参数见表2。
由图3可知,随着流速的增加,各离子穿透曲线均由右向左移动,同一离子穿透点和耗竭点依次提前,吸附平衡时间依次缩短,穿透曲线峰形变陡。这是因为随着流速增加,污染物进入吸附剂表面的传质阻力减小,水样在吸附柱内停留时间缩短,使得水样中各离子与吸附剂接触时间缩短,吸附效果减弱。由表2可知,在进水流速为4 mL/min时动态柱对各离子的动态吸附容量最高,进水流速过大和过小都不利于复合吸附剂的动态吸附。这是因为,在进水流速较大的情况下,水样停留时间短,吸附剂和水样接触时间缩短,不利于离子的扩散和吸附,从而对吸附物的传质效率产生负面影响;当进水流速较小时,水样停留时间较长,吸附效果相对较好,但单位时间内处理水样体积较少,在柱床内容易产生液相的纵向返混现象,且吸附剂的有效利用率较低[27]。

图3 不同流速时的穿透曲线
Fig.3 Breakthrough curves at different flow rates
2.1.3 进水质量浓度对穿透曲线的影响
图4显示了流速4.0 mL/min,吸附柱高度15 cm,每次仅改变F-,Fe2+,Mn2+中一种离子进水质量浓度(F-由5 mg/L变为10 mg/L,Fe2+由20 mg/L变为30 mg/L,Mn2+由5 mg/L变为10 mg/L)时的吸附穿透曲线。吸附传质参数见表3。为便于对比分析,将图3中F-,Fe2+,Mn2+进水质量浓度分别为5,20和5 mg/L,进水流速4.0 mL/min,吸附柱高度15 cm时的吸附穿透曲线一并在图4中显示。
表2 不同流速下Srp/HAP 的吸附参数
Table 2 Adsorption parameters of Srp/HAP at different flow rates
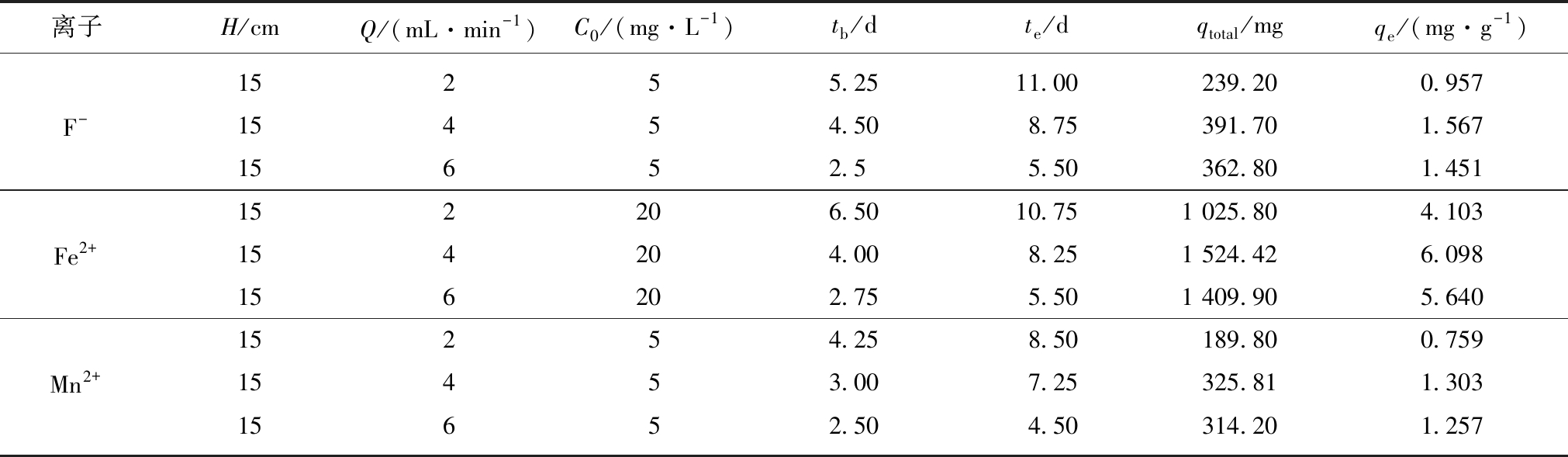
离子H/cmQ/(mL·min-1)C0/(mg·L-1)tb/dte/dqtotal/mgqe/(mg·g-1)15255.2511.00239.200.957F-15454.508.75391.701.56715652.55.50362.801.451152206.5010.751 025.804.103Fe2+154204.008.251 524.426.098156202.755.501 409.905.64015254.258.50189.800.759Mn2+15453.007.25325.811.30315652.504.50314.201.257

图4 不同初始质量浓度时的穿透曲线
Fig.4 Breakthrough curves at different initial concentrations
由图4可以看出,在增加F-,Fe2+,Mn2+初始质量浓度的情况下,各离子的穿透曲线从右向左移动,达到平衡时间提前。这表明较高的进水质量浓度会导致更高的传质驱动力,扩散系数或传质系数增加,吸附剂达到饱和速度更快。与F-,Fe2+,Mn2+进水质量浓度分别为5,20和5 mg/L,进水流速4.0 mL/min,吸附柱高度15 cm时的吸附穿透曲线对比分析可知,增大F-质量浓度可使Fe2+,Mn2+穿透曲线均向右移动,且2种离子吸附量均有增加,说明增大F-质量浓度可促进吸附剂对Fe2+,Mn2+的吸附;增大Fe2+,Mn2+的质量浓度时F-的穿透点和耗竭点均提前,吸附量减小,说明过多的金属离子对F-的吸附却产生抑制作用;增大Mn2+质量浓度使Fe2+穿透曲线前移,吸附量降低,而增大Fe2+质量浓度可使得Mn2+穿透曲线后移,吸附量增加,这是由于Mn2+对Fe2+的吸附存在竞争吸附活性位点的原因,并且Mn2+的竞争吸附能力强于Fe2+。由表3可知,随着进水质量浓度的增加,3种离子的动态吸附容量都增大了,这是由于较高的进水离子质量浓度增强了克服传质势垒的驱动力[28]。
综合表1~3数据可知,进水流速为4 mL/min、吸附柱高度15 cm时,动态柱对初始质量浓度分别为5,20和5 mg/L的F-,Fe2+,Mn2+的最大吸附容量分别为1.567,7.008,1.615 mg/g。
表3 不同初始质量浓度下Srp/HAP 的吸附参数
Table 3 Adsorption parameters of Srp/HAP at different initial concentrations
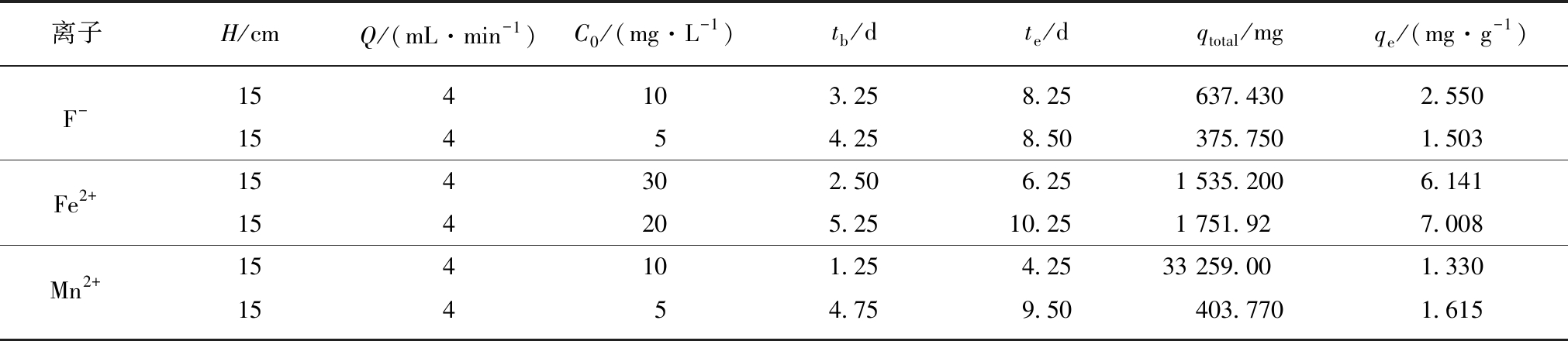
离子H/cmQ/(mL·min-1)C0/(mg·L-1)tb/dte/dqtotal/mgqe/(mg·g-1)F-154103.258.25637.4302.55015454.258.50375.7501.503Fe2+154302.506.251 535.2006.141154205.2510.251 751.927.008Mn2+154101.254.2533 259.001.33015454.759.50403.7701.615
分别应用Adams-Bohart模型和Thomas模型,在不同吸附剂填充高度、不同进水流速、不同初始质量浓度条件下,对Srp/HAP吸附复合试验水样中F-,Fe2+,Mn2+的吸附穿透曲线进行拟合,拟合结果见表4。
表4 Srp/HAP吸附F-,Fe2+,Mn2+的模型拟合参数
Table 4 Model parameters for adsorption of F-,Fe2+,Mn2+ on Srp/HAP

离子试验参数C0/(mg·L-1)Q/(mL·min-1)H/cmAdams-Bohart模型kAB/10-5N0/(104 mg·L-1)R2Thomas模型kThq0 /(mg·g-1)R25497.168 3.8650.940 0.1411.4920.987 54156.314 2.9860.920 0.0941.4870.963 54215.1972.5820.9720.0801.3590.972 F-52154.7471.9260.9070.0740.9420.984 54155.1513.2760.9380.0861.5290.975 56158.4643.0070.9310.1371.4080.976 104152.4035.7150.8250.0442.4950.95154155.7483.2430.8930.1031.4930.956 20491.79215.4590.9400.031 6.981 0.973204151.57911.9410.9200.026 5.677 0.947204211.29910.3320.9720.021 4.925 0.941Fe2+202151.3597.9030.9740.020 3.912 0.965 204151.57911.9410.9200.026 5.772 0.947 206152.31711.8440.9170.039 5.458 0.984 304151.16213.0790.8800.021 5.775 0.976204152.0297.0150.8270.043 2.977 0.9475497.4763.3160.8380.1251.5000.98154155.7462.6680.9130.0981.2400.97154215.6402.2280.9040.0961.0530.942Mn2+52155.4391.5440.9640.0870.7360.96754155.7462.6800.9130.0971.2400.971561510.0012.6040.9210.1671.1910.971104153.7123.1430.7500.0801.9080.93254156.4132.8710.8920.1141.3390.922
由表4可以看出,对于Adams-Bohart模型,无论F-还是Fe2+,Mn2+,随着吸附柱高度的增加,传质速率常数kAB和离子吸附饱和质量浓度N0均减小;随着F-,Fe2+,Mn2+离子初始质量浓度的增加,kAB减小但N0增大;随着流速增加,3种离子传质速率常数kAB均逐渐增大,而N0先增大后减小,在流速为4.0 mL/min时最大。对于Thomas模型,无论F-还是Fe2+,Mn2+,传质速率kTh均随着床深和质量浓度的增加而减小,随流速增加而增大,而吸附剂最大吸附容量q0则随着床深的增加而减小,随质量浓度增加而增大,也在流速为4.0 mL/min时最大,这与图3结果吻合。分析表明,改变吸附剂填充质量及进水流速,会影响水样在柱内的停留时间,改变各离子的质量浓度梯度,会为吸附传质过程提供更大的推动力,从而使吸附的3种离子更易战胜Srp/HAP表面的空间阻力,F-,Fe2+,Mn2+离子与吸附位点结合机会增多,Chowdhury用芒果干等果皮制成的颗粒活性炭吸附废水中Mn2+也得到类似的趋势[29]。对Srp/HAP动态吸附F-,Fe2+,Mn2+过程,Thomas模型拟合得到的相关系数R2(≥0.922)与Adams-Bohart(≥0.75)模型相比总体上更接近1,表明Thomas模型能更好描述Srp/HAP吸附F-,Fe2+,Mn2+的动力学特征。
2.3.1 比表面积孔隙度分析
表5为Srp,HAP及Srp/HAP复合颗粒的氮气吸附-脱附孔径分布结果。Srp/HAP制备成复合颗粒吸附剂后的比表面积达到42.10 m2/g,是HAP比表面积的1.9倍,更是Srp比表面积的7.9倍。由于吸附材料的比表面积越大,其表面的吸附位点也越多,因此Srp/HAP复合颗粒更有利于对F-,Fe2+,Mn2+离子的吸附。
表5 Srp,HAP和Srp/HAP的BET分析
Table 5 BET analysis of Srp,HAP and Srp/HAP
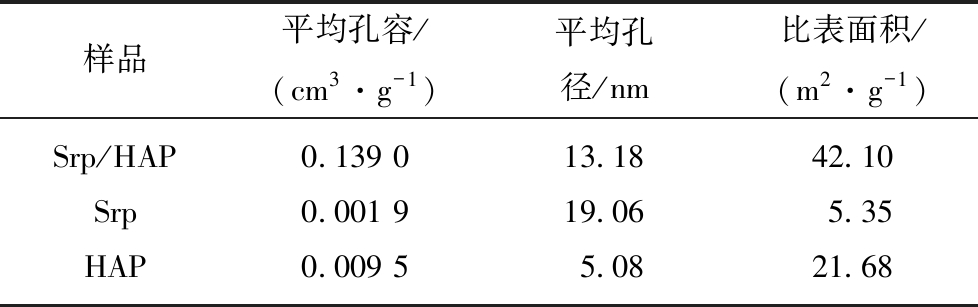
样品平均孔容/(cm3·g-1)平均孔径/nm比表面积/(m2·g-1)Srp/HAP0.139 013.1842.10Srp0.001 919.065.35HAP0.009 55.0821.68
2.3.2 X射线衍射分析
图5为Srp/HAP复合颗粒吸附试验水样前后的X射线衍射图谱。由图5可知,复合颗粒主要由HAP的Ca10(PO4)6(OH)2和Srp中的Mg3Si2(OH)4O5组成。Srp/HAP主要有5个特征峰(2θ为12.12°,25.76°,32.92°,33.96°,35.40°)。Srp/HAP复合颗粒吸附试验水样后的XRD出现了新的特征峰,利用XRD分析软件(X’Pert HighScore Plus)分析得出吸附后的材料形成了Fe3Si2(OH)4O5,Mn3Si2(OH)4O5,Ca5(PO4)3F化合物。试验水样中的F-与Ca10(PO4)6(OH)2的OH-,Fe2+与Mg3Si2(OH)4O5中的Mg2+,Mn2+与Mg3Si2(OH)4O5中的Mg2+分别发生离子交换反应,形成这3种新化合物,主要反应有:
2F-+Ca10(PO4)6(OH)2![]() 2Ca5(PO4)3F+2OH-
2Ca5(PO4)3F+2OH-
(5)
3Fe2++Mg3Si2(OH)4O5 ![]() Fe3Si2(OH)4O5+3Mg2+
Fe3Si2(OH)4O5+3Mg2+
(6)
3Mn2++Mg3Si2(OH)4O5 ![]() Mn3Si2(OH)4O5+3Mg2+
Mn3Si2(OH)4O5+3Mg2+
(7)

图5 Srp/HAP颗粒XRD衍射图谱
Fig.5 Srp/HAP particle XRD diffraction pattern
2.3.3 红外光谱分析

图6 Srp/HAP颗粒及其处理试验水样红外光谱图
Fig.6 Infrared spectrum of Srp/HAP particles and their treatment test water samples
图6为Srp/HAP颗粒吸附试验水样前后的红外光谱图。Srp/HAP复合颗粒在波数为449.41,563.21,1 058.9,1 091.66 cm-1处出现的振动峰归属于O—Mg,P![]() O,P—O和Si—O。在604.31和3 572.51 cm-1处的特征峰分别为OH—的弯曲振动和伸缩振动峰。以上所有吸收峰均与文献中蛇纹石和羟基磷灰石的标准峰相吻合[30-31]。在1 384.8 cm-1处的吸收峰为
O,P—O和Si—O。在604.31和3 572.51 cm-1处的特征峰分别为OH—的弯曲振动和伸缩振动峰。以上所有吸收峰均与文献中蛇纹石和羟基磷灰石的标准峰相吻合[30-31]。在1 384.8 cm-1处的吸收峰为![]() 的吸收峰,
的吸收峰,![]() 的产生是由于在制备Srp/HAP颗粒时候加入了硝酸钙溶液,而反应后在1 384.8 cm-1处的振动峰强度明显减弱,这是由于
的产生是由于在制备Srp/HAP颗粒时候加入了硝酸钙溶液,而反应后在1 384.8 cm-1处的振动峰强度明显减弱,这是由于![]() 溶于废水溶液中。在563.21 cm-1处O—P—O吸收峰减弱,可能是溶解所产生的
溶于废水溶液中。在563.21 cm-1处O—P—O吸收峰减弱,可能是溶解所产生的![]() 与Fe2+,Mn2+ 发生了表面络合反应,生成了磷酸盐络合物,刘国等[32]在研究羟基磷灰石/膨润土复合吸附材料吸附水中重金属离子Cd2+时也得到了相似的结论。
与Fe2+,Mn2+ 发生了表面络合反应,生成了磷酸盐络合物,刘国等[32]在研究羟基磷灰石/膨润土复合吸附材料吸附水中重金属离子Cd2+时也得到了相似的结论。
2.3.4 SEM分析
Srp,HAP,Srp/HAP复合颗粒及Srp/HAP处理试验水样后结构形态如图7所示。由图7(a)可见蛇纹石表面呈相互叠加的片状多孔卷曲结构,纹理明显,且在各纹理间存在明显凹凸状结构,表明蛇纹石具有较大的比表面积,使其具有较强的物理吸附能力;由图7(b)可知,羟基磷灰石表面颗粒团聚现象严重,孔隙分布不均匀;负载后(图7(c))形成的复合吸附剂颗粒紧实,既有Srp表面的片状卷曲结构,又解决了HAP表面团聚问题,负载后颗粒晶体生长紧凑且形状不规则,表面孔隙数量增多,可吸附位点增加,有利于F-,Fe2+,Mn2+离子的吸附;由图7(d)可知,吸附后Srp/HAP复合颗粒结构形态发生变化,表面存在直径1~3 μm的细小絮状体,可能是F-,Fe2+,Mn2+离子与Srp/HAP复合颗粒发生了表面物理吸附,也可能发生了表面络合反应[33]。

图7 Srp/HAP复合颗粒吸附F-,Fe2+,Mn2+前后的SEM-EDS图
Fig.7 SEM-EDS images of Srp/HAP compound particle before and after adsorption of F-,Fe2+,Mn2+
采用能谱仪对材料的元素进行进一步测定,由图7(e)可以看出,Srp/HAP复合颗粒主要含有O,Mg,Si,Ca,P等元素,由于Mg(0.066 nm)的离子半径比Ca(0.099 nm)小得多,因此Srp/HAP中Mg2+离子更易于与其他金属离子进行离子交换。吸附后的EDS(图7(f))图谱中出现F,Fe,Mn元素,而O元素质量分数从吸附前的56.19%降低到45.29%,Mg元素质量分数从吸附前的24.46%降低到18.03%,进一步表明F-与OH-,Fe2+与Mg2+,Mn2+与Mg2+可能发生了离子交换,与XRD分析结果吻合。
将羟基磷灰石(HAP)负载在蛇纹石(Srp)上制备成Srp/HAP复合颗粒。Srp/HAP复合颗粒由Ca10(PO4)6(OH)2和Mg3Si2(OH)4O5组成,溶液中含有F-时,F-部分取代Ca10(PO4)6(OH)2中的OH-,在羟基磷灰石的表面形成了Ca10(PO4)6F2[34]。Ca10(PO4)6F2(V=0.523 3 nm3)的晶胞体积V小于Ca10(PO4)6(OH)2(V=0.528 8 nm3)的晶胞体积V,由于晶胞不匹配,导致新形成的Ca10(PO4)6F2从羟基磷灰石表面脱落,从而SEM图中观察到细小Ca10(PO4)6F2颗粒存在,通过XRD实验可以观察到吸附后产生的Ca10(PO4)6F2晶体。溶液中存在Fe2+和Mn2+时,由于离子交换作用,Mg3Si2(OH)4O5(V=0.364 1 nm3)中的Mg2+被Fe2+和Mn2+取代,反应后出现了Fe3Si2(OH)4O5(V=0.391 4 nm3)、Mn3Si2(OH)4O5(V=0.408 2 nm3),由于晶胞体积不同,对Fe2+和Mn2+吸附后,Srp/HAP复合颗粒表面也会生成细小颗粒;通过XRD实验,可以观察到吸附Fe2+和Mn2+后形成的Fe3Si2(OH)4O5晶体和Mn3Si2(OH)4O5晶体。
另外,Srp/HAP复合颗粒吸附Fe2+和Mn2+,除了物理吸附和离子交换外,HAP晶体表面的![]() 与Fe2+和Mn2+也可能通过络合作用完成。BOGYA等[35]研究HAP对Cd2+吸附影响时表明,吸附剂表面
与Fe2+和Mn2+也可能通过络合作用完成。BOGYA等[35]研究HAP对Cd2+吸附影响时表明,吸附剂表面![]() 与重金属离子Cd2+通过表面络合作用实现吸附;胡冬雪等[36]在研究腐殖酸负载羟基磷灰石复合材料对重金属Cd2+吸附性能中,通过分子动力学分析证实Cd2+主要通过离子交换和络合反应被吸附到HAP的表面;MAVROPOULOS等[37]研究HAP吸附Pb2+过程表明,单独的离子交换作用不足以解释HAP对重金属离子的吸附机制,甚至推断在HAP吸附重金属离子的整个过程中都可能涉及表面络合作用。笔者在FT-IR分析中发现O-P-O吸收峰减弱,进一步证实了
与重金属离子Cd2+通过表面络合作用实现吸附;胡冬雪等[36]在研究腐殖酸负载羟基磷灰石复合材料对重金属Cd2+吸附性能中,通过分子动力学分析证实Cd2+主要通过离子交换和络合反应被吸附到HAP的表面;MAVROPOULOS等[37]研究HAP吸附Pb2+过程表明,单独的离子交换作用不足以解释HAP对重金属离子的吸附机制,甚至推断在HAP吸附重金属离子的整个过程中都可能涉及表面络合作用。笔者在FT-IR分析中发现O-P-O吸收峰减弱,进一步证实了![]() 与Fe2+,Mn2+ 发生了表面络合作用。
与Fe2+,Mn2+ 发生了表面络合作用。
综合微观表征结果,Srp/HAP复合颗粒对地下水中F-,Fe2+,Mn2+的吸附既有物理吸附,也有化学吸附,化学吸附主要表现为离子交换作用,也可能包括表面络合作用。
(1)通过SEM,EDS,XRD,BET,FT-IR的微观表征结果表明,制备的Srp/HAP复合吸附剂颗粒紧实,既有Srp表面的片状卷曲结构,又解决了HAP表面团聚问题,负载后颗粒晶体生长紧凑且形状不规则,表面孔隙数量增多,可吸附位点增加。与Srp,HAP相比,复合颗粒吸附剂的比表面积、孔容均较有明显增加,具有较好的表面孔隙结构,有利于氟、铁、锰的同步吸附去除。吸附过程不仅有表面物理吸附,也有包括离子交换、表面络合的化学吸附。
(2)动态柱传质区高度、进水流速和F-,Fe2+,Mn2+初始质量浓度都会对复合颗粒动态吸附的穿透过程产生影响。在吸附柱高度15 cm,进水流速为4 mL/min时,动态柱对初始质量浓度分别为5,20和5 mg/L的F-,Fe2+,Mn2+的动态吸附容量最大分别为1.567,7.008和1.615 mg/g。随着吸附柱高度的增加,各离子穿透曲线均从左向右移动,同一离子穿透点和耗竭点依次滞后,吸附平衡时间依次延长,动态吸附总量增加;随着流速的增加,各离子穿透曲线均由右向左移动,同一离子穿透点和耗竭点依次提前,吸附平衡时间依次缩短,穿透曲线峰形变陡,在进水流速为4 mL/min时动态柱对离子的动态吸附容量最高,进水流速过大和过小都不利于复合吸附剂的动态吸附;增加F-,Fe2+,Mn2+初始质量浓度,各离子的穿透曲线从右向左移动,达到平衡时间提前,3种离子的动态吸附容量都增大。
(3)对Srp/HAP动态吸附F-,Fe2+,Mn2+过程,Thomas模型拟合得到的相关系数R2(≥0.922)与Adams-Bohart(≥0.75)模型相比总体上更接近1,表明Thomas模型能更好描述Srp/HAP吸附F-,Fe2+,Mn2+的动力学特征。Thomas传质速率常数kTh均随着床深和质量浓度的增加而减小,随流速增加而增大,而吸附剂最大吸附容量q0则随着床深的增加而减小,随质量浓度增加而增大,在流速为4.0 mL/min时最大。改变吸附剂填充质量及进水流速,会影响水样在柱内的停留时间,改变各离子的质量浓度梯度,会为吸附传质过程提供更大的推动力,从而使吸附的3种离子更易战胜Srp/HAP表面的空间阻力,F-,Fe2+,Mn2+离子与吸附位点结合机会增多,吸附效果增强。
[1] ZHU Chi,WANG Shui,HU Kaiming,et al.Study on fluoride,iron and manganese removal from aqueous solutions by a novel composite adsorbent[J].Advanced Materials Research,2013,821-822:1085-1092.
[2] FAN Limin,MA Xiongde.A review on investigation of water-preserved coal mining in western China[J].International Journal of Coal Science & Technology,2018,5(4):411-416.
[3] 杨建,王强民,王甜甜,等.神府矿区井下综采设备检修过程中矿井水水质变化特征[J].煤炭学报,2019,44(12):3710-3718.
YANG Jian,WANG Qiangmin,WANG Tiantian,et al.Mine water quality variation during the overhaul of fully mechanized mining equipment in Shenfu mining area[J].Journal of China Coal Society,2019,44(12):3710-3718.
[4] 孙丽萍.地下水同步除锰降氟技术研究[D].西安:西安建筑科技大学,2011.
SUN Liping.The synchronous removal of manganese and fluorine performance in groundwater[D].Xi’an:Xi’an University of Architecture and Technology,2011.
[5] 贾翠萍,杨梦圆,薛鑫.Ca-Fe-Mg复合材料制备及其对矿区高氟水氟去除性能研究[J].中国矿业,2018,27(9):158-161.
JIA Cuiping,YANG Mengyuan,XUE Xin.Study on the preparation of Ca-Fe-Mg Composite and its properties for water fluoride ion removal in mining area[J].China Mining Magazine,2018,27(9):158-161.
[6] 孙长峰,郭娜.微量元素铁对人体健康的影响[J].微量元素与健康研究,2011,28(2):64-66.
SUN Changfeng,GUO Na.Trace element iron effects on human health[J].Studies of Trace Elements and Health,2011,28(2):64-66.
[7] BI Yinli,ZHANG Yanxu,ZOU Hui.Plant growth and their root development after inoculation of arbuscular mycorrhizal fungi in coal mine subsided areas[J].International Journal of Coal Science & Technology,2018,5(1):47-53.
[8] 何绪文,肖宝清,王平.废水处理与矿井水资源化[M].北京:煤炭工业出版社,2002:9.
[9] 朱其顺,许光泉.中国地下水氟污染的现状及研究进展[J].环境科学与管理,2009,34(1):42-44,51.
ZHU Qishun,XU Guangquan.The current situation and research progress of groundwater fluorine pollution,in China[J].Environmental Science and Management,2009,34(1):42-44,51.
[10] 孙亚军,陈歌,徐智敏,等.我国煤矿区水环境现状及矿井水处理利用研究进展[J].煤炭学报,2020,45(1):304-316.
SUN Yajun,CHEN Ge,XU Zhimin,et al.Research progress of water environment,treatment and utilization in coal mining areas of China[J].Journal of China Coal Society,2020,45(1):304-316.
[11] ANTHONY M Muliwa,TAILE Y Leswifi,ARJUN Maity,et al.Fixed-bed operation for manganese removal from water using chitosan/bentonite/MnO composite beads[J].Environmental Science and Pollution Research,2018,25(18):18081-18095.
[12] 张建锋,罗宁,王晓昌.地下水除铁除锰与同步降氟技术分析[J].中国农村水利水电,2009(5):10-11,14.
ZHANG Jianfeng,LUO Ning,WANG Xiaochang.Analysis of techniques for iron,manganese removal and synchronous defluoridation of ground water[J].China Rural Water and Hydropower,2009(5):10-11,14.
[13] GARGI Biswas,MANJARI Kumari,KALYAN Adhikari,et al.A critical review on occurrence of fluoride and its removal through adsorption with an emphasis on natural minerals[J].Current Pollution Reports,2017,3(2):104-119.
[14] 杨建,王皓,王甜甜,等.矿井水地下储存过程中典型污染组分去除规律——以内蒙古敏东一矿为例[J].煤炭学报,2020,45(8):2918-2925.
YANG Jian,WANG Hao,WANG Tiantian,et al.Removal law of typical pollution components during underground storage of mine water:Taking Mindong No.1 Mine Inner Mongolia as an example[J].Journal of China Coal Society,2020,45(8):2918-2925.
[15] FAIDT T,FRIEDRICHS A,GRANDTHYLL S,et al.Effect of fluoride treatment on the acid resistance of hydroxyapatite.langmuir:The ACS journal of surfaces and colloids[J].Langmuir,2018,34(50):15253-15258.
[16] POPA M,BOSTAN R,VARVARA S,et al.Removal of Fe,Zn and Mn ions from acidic mine drainage using hydroxyapatite[J]. Journal of Environmental Protection and Ecology,2016,17(4):1472-1480.
[17] MIRNA ![]() Fl-anagan.A review on adsorption of fluoride from aqueous solution[J].Materials,2014,7(9):6317-6366.
Fl-anagan.A review on adsorption of fluoride from aqueous solution[J].Materials,2014,7(9):6317-6366.
[18] SUNDARAM C S,VISWANATHAN N,MEENAKSHI S.Uptake of flfluoride by nano-hydroxyapatite/chitosan,a bioinorganic composite[J].Bioresource Technology,2008,99(17):8226-8230.
[19] 张连科,王洋,王维大,等.生物炭负载纳米羟基磷灰石复合材料的制备及对铅离子的吸附特性[J].化工进展,2018,37(9):3492-3501.
ZHANG Lianke,WANG Yang,WANG Weida,et al.The preparation of biochar-supported nano-hydroxyapatite and its adsorption of Pb2+[J].Chemical Industry and Engineering Progress,2018,37(9):3492-3501.
[20] 李喜林,尚方方,陈冬琴,等.蛇纹石吸附含氟地下水试验研究[J].非金属矿,2017,40(3):86-88.
LI Xilin,SHANG Fangfang,CHEN Dongqin,et al.Experimental study on adsorption of fluoride groundwater by serpentine[J].Non-Metallic Mines,2017,40(3):86-88.
[21] 曹春艳.蛇纹石对重金属吸附机制及对土壤重金属赋存形态影响[D].沈阳:沈阳农业大学,2017.
CAO Chunyan.Adsorption mechanism of heavy metals on serpentine and its effects on heavy metals formations in contaminated soil[D].Shenyang:Shenyang Agricultural University,2017.
[22] 佘臣杰,唐婕琳,何环,等.Desulfuromonas alkenivorans S-7联合稻壳处理酸性重金属废水[J].煤炭学报,2019,44(9):2851-2858.
SHE Chenjie,TANG Jielin,HE Huan,et al.Combining desulfuromonas alkenivorans S-7 with rice husk to treat acid heavy metal wastewater[J].Journal of China Coal Society,2019,44(9):2851-2858.
[23] 崔玉川,曹昉.煤矿矿井水处理利用工艺技术与设计[M].北京:化学工业出版社,2016.
[24] AZIZ A S A,MANAF L A,MAN H C,et al.Column dynamic studies and breakthrough curve analysis for Cd(II) and Cu(II) ions adsorption onto palm oil boiler mill fly ash(POFA)[J].Environmental Science and Pollution Research International,2014,21(13):7996-8005.
[25] FARRAG A E H A,MOGHNY T A,MOHAME A M G,et al.Abu Zenima synthetic zeolite for removing iron and manganese from Assiut governorate groundwater,Egypt[J].Applied Water Science,2017,7(6):3087-3094.
[26] TANG Hu,ZHOU Weijie,LU Ang,et al.Characterization of new sorbent constructed from Fe3O4/chitin magnetic beads for the dynamic adsorption of Cd2+ ions[J].Journal of Materials Science,2014,49(1):123-133.
[27] 杜志辉,贾铭椿,门金凤.聚丙烯腈-亚铁氰化钾钛球形复合吸附剂对水中Cs+的动态吸附性能[J].中南大学学报(自然科学版),2014,45(11):4100-4104.
DU Zhihui,JIA Mingchun,MEN Jinfeng.Dynamic performance of Cs+ adsorption from aqueous solution with polyacrylonitrile-potassium titanium hexacyanoferrate(Ⅱ) spherical composite adsorbent[J].Journal of Central South University(Science and Technology),2014,45(11):4100-4104.
[28] PRIYANKA Agrawal,BAJPAI A K.Dynamic column adsorption studies of toxic Cr(VI) ions onto iron oxide loaded gelatin nanoparticles[J].Journal of Dispersion Science and Technology,2011,32(9):1353-1362.
[29] CHOWDHURY Z Z,ZAIN S M,RASHID A K,et al.Breakth-rough curve analysis for column dynamics sorption of Mn(II) ions from wastewater by using mangostana garcinia peel-based granular-activated carbon[J].Journal of Chemistry,2012,2013:959761.
[30] 李合.以蛇纹石为原料制备陶瓷涂层的实验研究[D].北京:中国地质大学(北京),2006.
LI He.Study on the preparation of ceramic-coat with the serpentine[D].Beijing:China University of Geosciences(Beijing),2006.
[31] DHAND V,RHEE KY,PARK SJ.The facile and low temperature synthesis of nanophase hydroxyapatite crystals using wet chemistry[J].Materials Science and Engineering C,2014,36:152-159.
[32] 刘国,徐丽莎,李知可,等.羟基磷灰石/膨润土复合材料对水中Cd2+吸附研究[J].硅酸盐学报,2018,46(10):1414-1425.
LIU Guo,XU Lisha,LI Zhike,et al.Adsorption of cadmium on hydroxyapatite/bentonite composites in aqueous solution[J].Journal of the Chinese Ceramic Society,2018,46(10):1414-1425.
[33] 何豪,朱宗强,刘杰,等.镁-钙羟基磷灰石吸附剂对水中Pb2+的去除[J].环境科学,2019,40(9):4081-4090.
HE Hao,ZHU Zongqiang,LIU Jie,et al.Removal of Pb2+ from aqueous solution by magnesium-calcium hydroxyapatite adsorbent[J].Environmental science,2019,40(9):4081-4090.
[34] JIMÉNEZREYES M,SOLACHER OS M.Sorption behavior of fluoride ions from aqueous solutions by hydroxyapatite[J].Journal of Hazardous Materials,2010,180(1):297-302.
OS M.Sorption behavior of fluoride ions from aqueous solutions by hydroxyapatite[J].Journal of Hazardous Materials,2010,180(1):297-302.
[35] BOGYA E ![]() M,BARAB
M,BARAB S R,et al.Influence of synthesis method of nano-hydroxyapatite-based materials on cadmium sorption processes[J].Journal of the Iranian Chemical Society,2014,11(1):53-68.
S R,et al.Influence of synthesis method of nano-hydroxyapatite-based materials on cadmium sorption processes[J].Journal of the Iranian Chemical Society,2014,11(1):53-68.
[36] 胡冬雪,张飞杰,周燕,等.腐殖酸负载羟基磷灰石对废水中Cd2+吸附性能的影响[J].环境科学学报,2019,39(12):4022-4030.
HU Dongxue,ZHANG Feijie,ZHOU Yan,et al.Effect of humic acid load hydroxyapatite on the adsorption of Cd2+ in wastewater[J].Acta Scientiae Circumstantiae,2019,39(12):4022-4030.
[37] MAVROPOULOS E,ROSSI A M,COSTA A M,et al.Studies on the mechanisms of lead immobilization by hydroxyapatite[J].Environmental Science & Technology,2002,36(7):1625-1629.
LI Xilin,YU Xiaowan,LI Lei,et al.Dynamic adsorption of fluoride,iron and manganese in underground water of mining area by Srp/HAP[J].Journal of China Coal Society,2021,46(3):1056-1066.