陕北煤矿区地处黄河流域中游,属于黄土高原丘陵沟壑区,黄绵土是其主要土壤类型,土质疏松,土壤养分贫瘠,风蚀和水蚀较为严重且气候干旱,降水量较少。煤矿开采扰动了矿区环境,生态受损,土壤退化,农田土地生产力下降,生物修复成为土壤改良与促植物生长的热点技术。丛枝菌根真菌(Arbuscular Mycorrhiza Fungi,AMF)能与大多数陆地植物形成互利共生的关系[1]。根外菌丝增加了植物根系与土壤的接触面积,促进了根系对水分和养分的获取[2],并对宿主植物的氮、磷等养分的转移和分配产生影响,从而改变植物个体功能性状,如营养性状和表型性状等[3]。大量研究表明,AMF对植物生长具有显著促进作用,但有关干旱胁迫下AMF通过保持土壤水分进而影响植物表型和物质积累量的研究鲜有报道。因此,研究矿区干旱地接种AMF后土壤水分变化状况及其对植物冠层结构和根系形态变化的影响具有重要的研究意义,且对矿区干旱地环境治理和农业种植具有重要的指导意义。
植物表型指植物的外部形态特征,主要受基因型和环境因素的决定或影响[4]。植物表型可分为地上部的冠层表型和地下部的根系表型。植物体内积累的干物质中,90%以上直接或间接地来自冠层的光合作用,其余与植物根系吸收的营养物质相关[5]。冠层表型包括冠层高度、宽度、叶面积、叶倾角、分蘖数和分蘖基角等特征。PAULUS[6]在处理植物三维点云数据时,将植物的冠层表型分为非复杂性状和复杂性状,非复杂性状指利用完全植物冠层点云提取的性状,如高度、宽度、体积和粗略的叶面积估计等;复杂性状主要描述器官水平的冠层表型,如准确的叶面积、叶倾角、分蘖基角和果实计数等。根系结构对于植物水分和养分的获取、根系微生物的相互作用、防止土壤有毒元素和病原体进入叶片和生殖器官、养分贮藏以及增加产量等具有重要作用[7]。冠层和根系表型会因土壤条件(如氮[8]、水[9-10])、光照强度[10-11]等因素的不同表现出不同的结构特征,因此,研究植物的有益表型可为实现精准农业管理奠定较好的理论基础。
传统植物冠层表型数据的获取主要是通过手工测量,需要花费大量的时间,且精准度较低。近年来,随着科学技术的发展,高通量、精准高效的植物表型测定方法逐步得到开发,如荧光技术[12-13]、高光谱成像[14-16]、热成像[17] 与三维激光扫描[18]等技术。三维激光扫描植物获取三维点云数据,该技术不受自然光照的影响,便于田间测量,因此是目前应用较为广泛的主流表型测量技术。RICZU等[19]采用机载激光扫描仪获取点云数据,并对比研究了不同系统和软件建立的植物树枝模型,发现三维整形软件和geomagic软件构建的三维网状树模型能较好反映植物的冠层结构。毕银丽等[20]利用三维激光扫描技术研究了接种菌根对植株形态的影响规律。但对植物根系表型的测量目前仍存在一定的挑战,根系表型测量技术主要包括植物根系生长监测系统和根系CT扫描成像分析系统。
花生是我国重要的油料作物和经济作物,干旱胁迫会降低花生产量,为了研究干旱胁迫条件下接种AMF对农业土壤改良作用及其对花生表型结构及干物质积累量的影响,通过野外盆栽试验,采用EM50监测系统实时监测土壤水分变化情况,并用三维激光扫描技术和CI-690ROOTSNAP 根系分析软件系统分别测量统计花生的冠层和根系表型特征,研究干旱环境下接菌后花生植株生长特点和物质积累量变化,探究花生构型对干旱胁迫的响应,分析地上和地下表型的相关性以及接菌对根系特征及植株冠层结构的影响,为今后在陕北矿区干旱地生态农业建设提供研究依据。
1 材料与方法
1.1 试验材料
供试菌剂为AMF中的摩西管柄囊酶Funneliformis mosseae(F.m),孢子密度为66 个/g基质,由中国矿业大学(北京)微生物复垦实验室提供。供试作物为花生,品种为四粒红,购买于中国种子交易网。供试土壤为陕北矿区黄土母质上形成的黄绵土,该土壤全氮质量分数为0.24 g/kg,速效磷和速效钾质量分数分别为1.25 mg/kg和41.28 mg/kg,有机质质量分数为2.71 g/kg。
1.2 试验设计
试验于2020年7月在陕北张家峁矿区农业示范基地(N 38.8°,E 109.7°)进行。播种时,设置接种与不接种2种处理;出苗前统一供水,保持土壤含水量为田间最大持水量的70%,出苗后设置自然生长和干旱胁迫2种水分处理,共4个处理,分别为接菌处理(AMF)、对照处理(CK)、干旱接菌处理(干旱+AMF)和干旱处理,每个处理设8次重复,生长过程不再供水。试验用直径35 cm,高度35 cm的无底圆桶进行,桶底固定400目尼龙网。试验时,将桶埋入土中,边缘露出地表3 cm,然后将土壤过2 mm筛装入桶内,每桶装18 kg土壤,桶间距为100 cm。播种时,接菌处理在穴播处添加200 g 含有混合AMF根段和根际土的菌剂,对照处理添加200 g灭菌菌剂。在2020-07-15播种花生,每桶播种3粒,出苗后间苗至1株。间苗后在盆中土壤10 cm深处埋设土壤温湿度传感器并连接EM50土壤温湿盐监测系统和数据采集器监测土壤水分变化,设置时间间隔为24 h(图1)。

图1 实验田
Fig.1 Experimental field
1.3 取样及测定方法
在花生饱果期,选择无风天气,用HandySCAN 700手持式三维激光扫描仪扫描获得花生的三维冠层结构的点云数据,扫描精度为0.3 mm。扫描完成后创建网格,导出STL格式文件,使用geomagic 2015软件对网格数据进行处理,通过坐标转换、噪点删除、模型修补和数据提取等步骤,得到独立完整的三维花生植株模型[20],并提取花生的株高、冠幅、叶片总面积和叶面积指数等冠层表型数据。
花针成熟期,收集地上茎叶和地下根系。根系清洗后拍照取样,并用CI-690ROOTSNAP 根系分析软件系统分析根系表型;随机取少量新鲜细根样(约20个根段制片),用10% KOH溶液浸泡24 h,冲洗干净,采用酸性品红乳酸甘油染色液染色法染色,在显微镜(Motic Panthera Client)下观察测定花生的菌根侵染率[21](图2),采用干重法测定各处理花生的地上和地下部生物量。

图2 根系侵染
Fig.2 Root infection diagram
1.4 数据处理
使用Microsoft Excel 2010进行数据的整理和统计,采用PowerPoint 2019进行绘图。使用IBM SPSS Statistics 20.0软件进行LSD多重比较检验及方差分析,显著性水平P=0.05。
2 结果与分析
2.1 干旱胁迫和接种菌根对花生根系菌根侵染率的影响
图3为干旱处理和接菌处理对花生根系菌根侵染率的影响。由图3可知AMF处理和对照均有AMF的侵染,表明野外自然环境中的土著菌根菌对花生根系具有一定的侵染,在相同处理条件下,AMF处理花生的菌根侵染率显著高于对照处理(P<0.05),表明接菌对花生具有显著的侵染效果。干旱+AMF处理与干旱处理花生的菌根侵染率间无显著差异,AMF处理和干旱+AMF处理的菌根定制率分别比对照处理增加16%和9%,表明干旱对花生菌根侵染具有显著不利影响。由图3可知,与正常条件下花生的菌根侵染率相比,干旱处理可显著降低菌根侵染率(P<0.05),干旱+AMF处理花生的菌根侵染率较AMF处理花生侵染率降低了59%,同样干旱处理侵染率较正常对照处理降低了66%。

图中不同字母表示 0.05 水平上差异显著,下图同
图3 不同处理花生根系的菌根侵染率
Fig.3 Mycorrhizal infection rate of peanut root under different treatments
2.2 接种菌根对花生根系土壤水分变化的影响
图4为接种菌根对花生根系土壤水分变化的影响,可以看出,AMF处理的土壤含水率维持在13%~20%,而CK处理维持在10%~16%,干旱+AMF处理和干旱对照处理的土壤含水率在植物生长25 d后均低于15%,但25 d后干旱+AMF处理的土壤含水率下降缓慢,始终维持在13%以上,而干旱处理的土壤含水率持续下降,在40 d时低于10%,表明接种菌根对花生根系土壤具有较好的保水作用。

图4 不同处理土壤水分的变化情况
Fig.4 Changes of soil moisture under different treatments
2.3 干旱胁迫下接种菌根对花生植株冠层表型的影响
2.3.1 干旱和接种菌根对花生植株地上生物量的影响
由图5可知,AMF处理的地上生物量显著高于正常对照处理,干旱+AMF处理的地上生物量显著高于干旱处理,表明接种菌根促进了花生植株的生长,增大了地上部分的物质积累量;在相同接菌和对照条件下,干旱处理的地上生物量均显著低于正常处理,表明干旱处理降低了花生地上部分的物质积累量,抑制了花生植株的生长。干旱+AMF处理比对照的地上生物量略高,差异不显著,表明接菌可以减弱干旱胁迫对植物生长的影响,接菌有一定抗旱潜力。
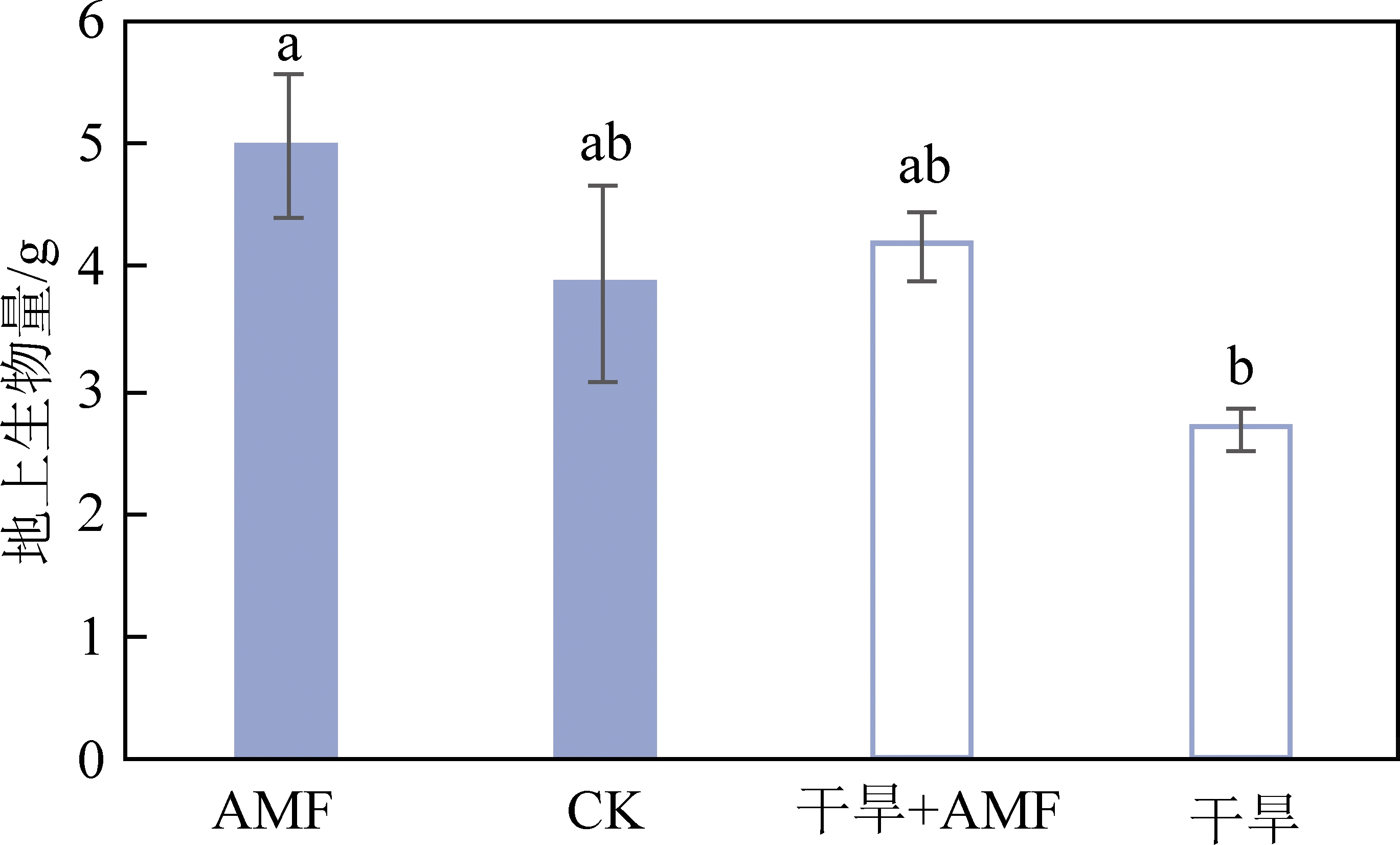
图5 不同处理花生地上生物量
Fig.5 Aboveground biomass of peanut under different treatments
2.3.2 干旱和接种菌根对花生冠层表型的影响
表1为干旱和接种菌根处理对花生冠层表型的影响。由表1可知,AMF处理的株高、投影面积、叶片数、叶片总面积、上层平均叶面积和开花数较CK组分别提高14.7%,6.0%,13.0%,7.5%,13.9%和22.7%;干旱+AMF处理的投影面积、叶片数、叶片总面积、上层平均叶面积、叶面积指数和开花数较干旱处理分别提高37.0%,13.2%,38.0%,26.0%,16.0%和57.0%;说明在不同土壤水分处理条件下,接菌均促进了花生地上冠层部分的生长,从而增大植株接受光照的面积,为增加光合积累量和产量提供物质基础。AMF处理的投影面积、叶片数、叶片总面积、上层平均叶面积、叶面积指数均大于干旱+AMF处理,CK处理的投影面积、叶片数、叶片总面积、上层平均叶面积、叶面积指数均大于干旱处理,表明干旱胁迫抑制了花生植株冠层部分的生长。
表1 不同处理对花生的冠层结构的影响
Table 1 Effects of different treatments on canopy structure of peanut

处理株高/cm投影面积/cm2叶片数/个叶片总面积/cm2上层平均叶面积/cm2叶面积指数开花数/个AMF10.71+0.62a191.63+16.33ab132.5+10.99a247.0+23.60ab5.16+0.45ab1.35+0.02ab6.75+1.55bCK9.34+0.34a180.69+13.12ab117.0+10.02ab229.74+17.61ab4.53+0.08ab1.38+0.03ab5.50+1.04b干旱+AMF10.41+0.75a226.99+10.68a103.0+9.52b294.08+17.26a5.28+0.36a1.44+0.02a11.00+1.68a干旱9.43+0.45a165.62+24.14b91.0+5.79b212.77+29.45b4.18+0.37b1.24+0.04b7.00+2.55b
注:同列不同字母为差异达到显著性水平P<0.05。
由于冠层结构监测时间为生长大约45 d时,此时干旱+AMF处理的土壤含水率还维持在15%左右,土壤水分含量还未对作物生长有所抑制,且干旱+AMF由于设置遮雨设施,土壤水分较稳定,且AMF对其生长起到了一定的促进作用。而AMF处理是自然降雨,水分过多也会一定程度的影响植物生长,因此中期干旱+AMF处理的冠层结构数据表现出最高的趋势,但之后随着干旱处理土壤水分逐渐下降,植物的生长也逐渐受到抑制作用。
在干旱条件下接种菌根对花生植株冠层表型的提高幅度明显大于在正常水分条件的对照,表明在干旱胁迫逆境环境中,接种菌根可缓解干旱胁迫对植物生长的影响。
2.4 干旱胁迫下接种菌根对花生植株根系表型的影响
图6为根系采集照片,分为整体部分和零碎部分,利用根系分析软件分别进行处理,最后一起统计。

图6 根系实物
Fig.6 Root physical map
图7为干旱和接种菌根对花生根系及其构成的影响。由图7可知,在不同土壤水分处理条件下,接种菌根均提高了花生的地下根系的物质积累量和平均根直径,其中在正常处理条件下达到显著水平,表明接种菌根促进花生植株根系的生长,从而更好的促进花生对土壤水分和养分的吸收。图8为干旱和接种菌根对花生根系及其构成的影响,可以看出,在正常水分条件下,接种菌根增大了花生植株根系的总根长、总根体积和总根表面积,其中对总根体积和总根表面积的促进作用达到显著性差异水平(P<0.05),表明在正常水分条件下接种菌根对花生植株根系的生长具有促进作用;而在干旱条件下,接种菌根对花生植株根系的总根长、总根体积和总根表面积的促进作用不明显,表明在干旱胁迫条件下,由于干旱胁迫抑制菌根的生长,使根系菌根侵染率较低,从而对根系总根长、总根体积和总根表面积的促进作用不明显。

图7 不同处理花生的根系生物量和平均根直径
Fig.7 Root biomass and mean root diameter of peanut under different treatments
由图8可知,在正常水分条件下,接种菌根增加较粗根所占的比例,其中接菌处理花生根系中根系直径大于0.1 mm和在0.08~0.10 mm的根所占比例分别为9.4%和18.3%,而对照处理所占比例分别为2.7%和13.6%。在干旱条件下,接种菌根能增加较粗根和较细根所占的比例,其中接菌处理花生根系中大于0.08 mm的根所占比例为26.7%,小于0.06 mm的根所占比例为25.2%,而对照处理大于0.08 mm的根所占比例为8.1%,小于0.06 mm的根所占比例为15.7%。接菌对根系的促进作用明显,减弱干旱胁迫对根系生长的影响。

图8 不同处理花生的总根长、总根表面积和总根体积
Fig.8 Total root length,total root surface area and total root volumeof peanut under different treatments
2.5 冠层与根系表型的相关性分析
以冠层结构指标(株高、叶片数、叶片总面积)、根系性状指标(总根长、总根体积、总根表面积和平均根直径)、地上生物量和地下生物量共9个指标为变量,进行相关性分析。由表2可知,花生植株的地下生物量与地上生物量呈显著正相关,相关系数为0.84(P<0.01);叶片数、叶片总面积在0.01水平上与地上生物量显著正相关,相关系数分别为0.82和0.81,而株高、总根体积、平均根直径在0.05水平上与地上生物量呈显著正相关,相关系数分别为0.50,0.52和0.56;叶片数、叶片总面积、总根体积、总根表面积在0.01水平上与地下生物量呈显著正相关,相关系数分别为0.72,0.64,0.72和0.64,而平均根直径在0.05水平上与地下生物量呈显著正相关,相关系数为0.54;总根体积、平均根直径与叶片数呈显著正相关,相关系数分别为0.60和0.66(P<0.01)。
3 讨 论
陆地大多数植物能够被AMF侵染,并与菌根形成互利共生的关系。有研究表明,干旱胁迫会抑制菌根的生长和孢子的萌发,从而降低宿主植物的根系菌根侵染率[22]。吴会会等[23]在研究干旱条件下AMF对枳实生苗生长的影响的过程中,发现干旱胁迫降低了枳根系的菌根侵染率,抑制了枳植株的生长。与本研究结果相似,在后期干旱胁迫降低了花生根系菌根的侵染率,抑制了花生植株冠层和根系的生长。在野外条件下,土壤中富含多种微生物,但在干旱缺水的环境下,土壤中微生物多样性降低,土著菌根菌数量减少[24],也会使花生根系的侵染率降低。
表2 冠层和根系表型的相关性分析
Table 2 Correlation analysis between canopy and root phenotype

指标株高相关系数叶片数叶片总面积地上生物量总根长总根体积总根表面积平均根直径地下生物量株高10.350.498∗0.527∗-0.0440.1690.0890.2440.363叶片数10.787∗∗0.823∗∗0.1680.601∗0.4530.658∗∗0.72∗∗叶片总面积10.806∗∗0.0670.3520.2520.4280.637∗∗地上生物量10.1190.536∗0.3870.563∗0.842∗∗总根长10.698∗∗0.896∗∗0.0990.439总根体积10.943∗∗0.76∗∗0.715∗∗总根表面积 10.519∗0.641∗∗平均根直径10.535∗地下生物量1
注:**为2个指标在0.01水平(双侧)上显著相关;*为2个指标在0.05水平(双侧)上显著相关;样本数n=32。
植物所需的水分主要来自于根系吸收的水分,根外菌丝可以将水分输送到宿主根系,提高植物根系水分吸收率[25],满足植物的生长需要。本研究结果也表明接种菌根对土壤具有很好的保水作用,降低了干旱胁迫对花生植株生长的抑制作用。主要原因是接种菌根增加了植物根系的菌根侵染率,使更多的菌丝穿过盆底固定的尼龙网,帮助根系吸收盆以外更深层的水分和养分,从而维持盆内土壤的含水量,实现了对土壤的保水功能和对植物生长的促进功能。
干旱胁迫会导致植物细胞原生质脱水,抑制植物的生长[26],而AMF可以通过形成菌丝网络帮助植物获取根系无法到达处的水分和养分[27],进而促进植物表型发育,增加根系的直径、改变叶片的形状和加快植物光合速率,帮助植物适应恶劣的环境[28]。张亚敏等[29]研究发现干旱胁迫条件下,接种摩西球囊霉促进豆科灌木小马鞍羊蹄甲物质积累量、增加根系面积。屈明华等[30]研究表明接种AMF提高了任豆的根系生物量、根尖数、分叉数、交叉数和投影面积,改变任豆根系结构特征,构建了密集的菌根网络系统,从而促进根系对土壤养分吸收和幼苗生长。本研究结果表明干旱条件下接菌减缓了干旱胁迫对植株生长的抑制作用,增大了花生植株的投影面积、叶片总面积、叶片数、平均根直径、总根长、总根体积和总根面积,还增加了根直径和根系中较细根所占比例。植物根系中较细和较长的根帮助植物吸收更多的水分和养分,而较粗的根负责将水分和养分输送到冠层[31]。本研究表明接菌不仅通过在根部形成菌丝网络促进养分吸收,还通过增加根直径和较细根所占比例来促进植物对水分、养分的吸收和利用,促进植物地上和地下表型的发育。
此外,花生属于豆科植物,其本身具有的根瘤菌可以帮助其固定大气中的氮气为己所用,有研究表明,AMF和根瘤菌具有密切的联系[32],AMF的侵染可以增加豆科植物根系的根瘤数,提高其生物固氮能力[33],促进植物生长。因此接菌对花生表型的影响受多种因素的影响。
根系和冠层两大功能器官之间即相互依赖又相互竞争。根部为地上光合作用提供所需的水分和养分,而地上部通过光合作用提供根部呼吸所需的糖分,因此植物根系与冠层具有较大的相关性[34]。本研究中花生植株的总根体积、平均根直径与地上生物量显著正相关,叶片数、叶片总面积、与地下生物量呈显著正相关,总根体积、平均根直径与叶片数呈显著正相关。
通过对花生根系直径进行分层处理,揭示了接菌对不同级别根系的促生作用效率,但未研究不同根系构成对植物生长的影响程度。不同植物根系的构型不同,其水分和养分的吸收功能不同,对植物的生长发育起着不同的作用,后期可针对植物根系的不同构成结构与植物生长发育的关系深入揭示植物对干旱逆境的适应性机理研究将具有重要的生态意义。
4 结 论
(1)干旱胁迫降低AMF的侵染率,抑制植物生长;野外接种AMF对土壤具有保水作用,土壤含水量大小为:AMF>干旱+AMF>CK>干旱+CK的趋势。
(2)干旱条件下AMF对植物冠层生长促进作用较明显;接菌处理的投影面积、叶片数、叶片总面积、上层平均叶面积和开花数在正常条件下较对照组分别提高6.0%,13.0%,7.5%,13.9%和22.7%,在干旱条件下分别较对照组提高37.0%,13.2%,38.0%,26.0%和57.0%;接菌可减缓植物对干旱胁迫的影响。
(3)接菌可增加根系直径大于0.08 mm根系所占的比例。在正常水分条件下,接菌处理的根系直径大于0.1 mm和0.08~0.1 mm的根分别占9.38%和18.27%,而对照处理占2.7%和13.6%;干旱条件下,接菌处理的根系直径大于0.08 mm的根占26.7%,而对照的占8.1%。
(4)地下根系表型与地上冠层表型具有显著相关性,如平均根直径与叶片数显著正相关,相关系数为0.66,而叶片数与地上生物量显著正相关,相关系数为0.82,即平均根直径越大,叶片数越多,地上生物量越大。
[1] 刘娜,赵泽宇,姜喜铃,等.菌根真菌提高植物抗旱性机制的研究回顾与展望[J].菌物学报,2021,40(4):851-872.
LIU Na,ZHAO Zeyu,JIANG Xiling,et al.Review and prospect of researches on the mechanisms of mycorrhizal fungi in improving plant drought resistance[J].Mycosystema,2021,40(4):851-872.
[2] DECLERCQ I,CAPPUYNS V,DUCLOS Y.Monitored natural attenuation (MNA) of contaminated soils:State of the art in Europe-A critical evaluation[J].Science of the Total Environment,2012,426(2):393-405.
[3] 杨应,何跃军,董鸣,等.丛枝菌根网络对不同喀斯特适生植物生长及氮摄取的影响[J].生态学报,2017,37(24):8477-8485.
YANG Ying,HE Yuejun,DONG Ming,et al.Effects of common mycorrhizal networks on nitrogen acquisition and growth traits of different plants in karst areas[J].Acta Agronomica Sinica,2017,37(24):8477-8485.
[4] 潘映红.论植物表型组和植物表型组学的概念与范畴[J].作物学报,2015,41(2):175-186.
PAN Yinghong.Analysis of concepts and categories of plant phenome and phenomics[J].Acta Agronomica Sinica,2015,41(2):175-186.
[5] CHANG Tiangen,ZHAO Honglong,WANG Ning,et al.A three-dimensional canopy photosynthesis model in rice with a complete description of the canopy architecture,leaf physiology,and mechanical properties[J].Journal of Experimental Botany,2019,70(9):2479-2490.
[6] PAULUS S.Measuring crops in 3D using geometry for plant phenotyping[J].Plant Methods,2019,15(1-4):275-284.
[7] TRACY S R,NAGEL K A,POSTMA J A,et al.Crop improvement from phenotyping roots:Highlights reveal expanding opportunities[J].Trends in Plant Science,2020,25(1):105-118.
[8] GIOIA T,NAGEL K A,BELEGGIA R.et al.Impact of domestication on the phenotypic architecture of durum wheat under contrasting nitrogen fertilization[J].Journal of Experimental Botany,2015,66(18):5519-5530.
[9] CHOCHOIS V,VOGEL J P,REBETZKE G J,et al.Variation in adult plant phenotypes and partitioning among seed and stem-borne roots across brachypodium distachyon accessions to exploit in breeding cereals for well-watered and drought environments[J].Plant Physiology,2015,168(3):953-967.
[10] NAGEL K A,BONNETT D,FURBANK R,et al.Simultaneous effects of leaf irradiance and soil moisture on growth and root system architecture of novel wheat genotypes:Implications for phenotyping[J].Journal of Experimental Botany,2015,66(18):5441-5452.
[11] PFEIFER J,FAGET M,WALTER A,et al.Spring barley shows dynamic compensatory root and shoot growth responses when exposed to localised soil compaction and fertilization[J].Funct.Plant Biology,2014,41(6):581-597.
[12] GUANTER L,ZHANG Yongguang,JUNG M,et al.Global and time-resolved monitoring of crop photosynthesis with chlorophyll fluorescence[J].Proceedings of the National Academy of Sciences,2014,111(14):E1327-E1333.
[13] STIRBET A,LAZ R D,KROMDIJK J,et al.Chlorophyll a fluorescence induction:Can just a one-second measurement be used to quantify abiotic stress responses?[J].Photosynthetica,2018,56(1):86-104.
R D,KROMDIJK J,et al.Chlorophyll a fluorescence induction:Can just a one-second measurement be used to quantify abiotic stress responses?[J].Photosynthetica,2018,56(1):86-104.
[14] SINGHA M,WU B F,ZHANG M,et al.An object-based paddy rice classification using multi-spectral data and crop phenology in Assam,Northeast India[J].Remote Sensing,2016,8(6):479.
[15] DENG L,MAO Z H,LI X J,et al.UAV-based multispectral remote sensing for precision agriculture:A comparison between different cameras[J].ISPRS Journal of Photogrammetry and Remote Sensing,2018,146:124-136.
[16] IBRAHIM W,OLA H,MAGNUS J.Remote sensing of yields:Application of UAV imagery-derived NDVI for estimating maize vigor and yields in complex farming systems in Sub-Saharan Africa[J].Drones,2018,2(3):28.
[17] LUDOVISI R,TAURO F,SALVATI R,et al.UAV-based thermal imaging for high-throughput field phenotyping of black poplar response to drought[J].Frontiers in Plant Science,2017,8:1681.
[18] JIMENEZ Berni J A,DEERY D M,ROZAS Larraondo P,et al.High throughput determination of plant height,ground cover,and above-ground biomass in wheat with LiDAR[J].Frontiers in Plant Science,2018,9:237.
[19] RICZU P,TAM S J,NAGY A,et al.3D laser scanning and modeling of single trees in Karcag research center[J].Analele Universitǎ
S J,NAGY A,et al.3D laser scanning and modeling of single trees in Karcag research center[J].Analele Universitǎ
 ii Din Oradea Fascicula Protec
ii Din Oradea Fascicula Protec ia Mediului,2011,17:277-284.
ia Mediului,2011,17:277-284.
[20] 毕银丽,余海洋,YRYSZHAN Zhakypbek,等.三维激光扫描技术对接种菌根植株形态的影响规律[J].煤炭学报,2016,41(8):2071-2077.
BI Yinli,YU Haiyang,YRYSZHAN Zhakypbek,et al.Morphological characteristics of mycorrhizal plant based on 3D laser scanning technology[J].Journal of China Coal Society,2016,41(8):2071-2077.
[21] 郭静,罗培宇,杨劲峰,等.长期施肥对棕壤丛枝菌根真菌群落结构及其侵染的影响[J].中国农业科学,2018,51(24):4677-4689.
GUO Jing,LUO Peiyu,YANG Jinfeng,et al.Influence of long-term fertilization on community structures and colonization of arbuscular mycorrhizal fungi in a brown soil[J].Science Agricultura Sinica,2018,51(24):4677-4689.
[22] TYAGI J,VARMA A,PUDAKE R N.Evaluation of comparative effects of arbuscular mycorrhiza (Rhizophagus intraradices) and endophyte (Piriformospora indica) association with finger millet (Eleusine coracana) under drought stress[J].European Journal of Soil Biology,2017,81:1-10.
[23] 吴会会,邹英宁,吴强盛.干旱胁迫下AMF对盆栽枳实生苗生长和活性氧代谢的影响[J].中国南方果树,2018,47(2):36-38,45.
WU Huihui,ZOU Yingning,WU Qiangsheng.Effects of arbuscular mycorrhizal on growth and reactive oxygen metabolism of trifoliate orange under drought stress[J].South China Fruits,2018,47(2):36-38,45.
[24] 陈铭.土壤水分对油茶根际微生物多样性的影响[D].长沙:中南林业科技大学,2020.
CHEN Ming.Effects of soil moisture on microbial diversity in the rhizosphere of Camellia oleifera[D].Changsha:Central South University of Forestry & Technology,2020.
[25] 邢丹,王震洪,申刚,等.丛枝菌根真菌对岩溶区植物水分吸收利用的促进作用探讨[J].世界林业研究,2019,32(3):24-29.
XING Dan,WANG Zhenhong,SHEN Gang,et al.Promoting mechanism of arbuscular mycorrhizal fungi on plants water absorption and utilization in karst area[J].World Forestry Research,2019,32(3):24-29.
[26] 李娇娇,曾明.丛枝菌根对植物根际逆境的生态学意义[J].应用生态学报,2020,31(9):3216-3226.
LI Jiaojiao,CENG Ming.Ecological significance of arbuscular mycorrhiza on plant rhizosphere stress[J].Chinese Journal of Applied Ecology,2020,31(9):3216-3226.
[27] SMITH S E,SMITH F A.Fresh perspectives on the roles of arbuscular mycorrhizal fungi in plant nutrition and growth[J].Mycologia,2012,104(1):1-13.
[28] 杨文亭,冯远娇,王建武.丛枝菌根真菌在寄主植物抵御生物和非生物胁迫中的作用[J].生态科学,2008(4):267-271.
YANG Wenting,FENG Yuanjiao,WANG Jianwu.Review on the role of arbuscular mycorrhizal fungi in host plants under biotic and abiotic stresses[J].Ecological Science,2008(4):267-271.
[29] 张亚敏,马克明,曲来叶.干旱条件下接种AM真菌对小马鞍羊蹄甲幼苗根系的影响[J].生态学报,2017,37(8):2611-2619.
ZHANG Yamin,MA Keming,QU Laiye.Inoculation with arbuscular mycorrhizal fungi enhances the root system of bauhinia faberi var.microphylla seedlings under drought stress conditions[J].Acta Ecologica Sinica,2017,37(8):2611-2619.
[30] 屈明华,俞元春,王佳,等.喀斯特土壤条件下丛枝菌根真菌侵染对任豆幼苗生物量分配和根系结构特征的影响[J].生态学杂志,2021,40(3):766-776.
QU Minghua,YU Yuanchun,WANG Jia,et al.Effects of arbuscular mycorrhizal fungi infection on biomass distribution and root architecture characters of zenia insignis seedlings in karst soil[J].Chinese Journal of Ecology,2021,40(3):766-776.
[31] TRACY S R,NAGEL K A,POSTMA J A,et al.Crop improvement from phenotyping roots:Highlights reveal expanding opportunities[J].Trends in Plant Science,2020,25(1):105-118.
[32] GAVITO M E,CURTIS P S,MIKKELSEN T N,et al.Atmospheric CO(2) and mycorrhiza effects on biomass allocation and nutrient uptake of nodulated pea (Pisum sativum L.) plants[J].Journal of Experimental Botany,2000,51(352):1931-1938.
[33] ABD-ALLA M H,EL-ENANY A W E,NAFADY N A,et al.Synergistic interaction of Rhizobium leguminosarum bv.viciae and arbuscular mycorrhizal fungi as a plant growth promoting biofertilizers for faba bean (Vicia faba L.) in alkaline soil[J].Microbiological Research,2014,169(1):49-58.
[34] 师植生.植物根与地上部的相关性[J].植物杂志,1977(3):30-32.
SHI Zhisheng.Correlation between roots and aboveground parts of plants[J].Plant Magazine,1977(3):30-32.
